
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Из представленных соединений выберите изомер глутаминовой кислоты по функциональной группе
а) НООС–СН2СН2СН(ОН)–СОNH2; б) H2NCО–СН2СН2СН(NН2)–COOH;
в) HOOC–СН2CH(NH2)СН2–COOH; г) HOOC–СН2CH(NH2)–COOH.
2. Какую среду покажет раствор лизина при растворении в дистиллированной воде: а) нейтральную; б) слабокислую; в) слабощелочную?
3. Какая кислота образуется при дезаминировании валина in vitro:
а) 3-метил-2-оксобутановая; б) 3-метил-2-бутеновая; в) 2-метил-3-оксобутановая; г) 2-гидрокси-3-метилбутановая; д) 2-метилбутандиовая?
4. Какое органическое соединение получится из серина при действии на него фермента декарбоксилазы: а) 2-амино-1-этанол; б) 2-аминопропановая кислота; в) 3- гидроксипропановая кислота; г) 3-оксо-2-аминопропановая кислота; д) пропандиовая кислота?
5. Реакция на серусодержащие аминокислоты (реакция Фоля) меняет окраску раствора аминокислоты от бесцветной до: а) жёлтой, б) сине-фиолетовой, в) васильковой, г) чёрной.
6. При взаимодействии с конц. азотной кислотой раствор аминокислоты приобрёл жёлтый цвет, перешедший в оранжевый при подщелачивании (ксантопротеиновая реакция). Это был раствор: а) аланина, б) серина, в) аспарагина, г) тирозина, д) метионина?
7. Вторичная структура белка — это: а) последовательность аминокислотных остатков в полипептидной цепи; б) укладка полипептидной цепи в виде спирали или складчатой структуры; в) укладка полипептидной цепи в трёхмерную конфигурацию; г) комплекс из нескольких отдельных полипептидных цепей.
8. Закрепление конформации в третичной структуре белка происходит, в основном, за счёт связей: а) водородных; б) ионных; в) гидрофобных (силы Ван-дер-Ваальса); г) кислородных; д) азотных; е) дисульфидных.
9. Приведите структурную формулу лейцина и сокращённое обозначение его аминокислотного остатка. Назовите эту аминокислоту по правилам международной номенклатуры. Приведите (если это возможно) один изомер положения функциональной группы, один изомер функциональной группы и один изомер строения углеродного скелета. Изобразите L и D- энантиомеры.
ТЕМА 12. Углеводы: моно, ди- и полисахариды
Углеводы разделяют на простые (моносахариды) и сложные (полисахариды).
Моносахариды (монозы). Это гетерополифункциональные соединения, содержащие карбонильную и несколько гидроксильных групп. Моносахариды имеют молекулярную формулу Сп(Н2О)п, которая и послужила основой для названия данного класса соединений (углерод + вода). По своей структуре монозы относятся к полиоксиальдегидам, или альдозам, или полиоксикетонам, или кетозам. В зависимости от числа атомов углерода монозы делят на триозы (три атома углерода), тетрозы (четыре атома), пентозы (пять атомов), гексозы (шесть атомов) и гептозы (семь атомов). В зависимости от строения карбонильной группы каждую из моноз обозначают: альдотриоза, альдогексоза, кетогексоза и т.п.
Оптическая изомерия моносахаридов. Характерной особенностью структуры моносахаридов является наличие в молекулах асимметрических (т.е. имеющих четыре различных заместителя) атомов углерода. Асимметрические атомы углерода представляют собой центры хиральности молекулы. Следствие хиральности молекулы – явление оптической изомерии, или энантиомерии, которое выражается в способности соединения вращать плоскость поляризованного света в противоположные стороны. Соединение с асимметрическими атомами углерода может существовать в виде 2 изомеров. В соединениях с одинаковыми асимметрическими атомами углерода число оптических изомеров уменьшается вследствие существования мезоформ. Мезо-соединения оптически неактивны из-за «внутренней компенсации» знака вращения. Примером мезо-соединения является D-ксилит.
Оптические изомеры, относящиеся друг к другу как несимметричный предмет к своему зеркальному отображению, называют энантиомерами, или оптическими антиподами. Энантиомеры отличаются друг от друга конфигурацией всех центров хиральности и образуют D-форму (лат.Dexter — правый) и L-форму (лат. laevus — левый) — стереохимические ряды моносахаридов. Изомеры, отличающиеся конфигурацией только части центров хиральности и не являющиеся оптическими антиподами, называют диастереомерами. Пару диастереомеров, отличающихся конфигурацией только одного асимметрического атома углерода, называют эпимерами.Обычно к названию добавляют номер эпимерного атома углерода, 2-эпимеры называют просто эпимерами. Например, D-аллоза и D-альтроза – эпимеры, D-аллоза и D-глюкоза – 3-эпимеры, D-аллоза и D-гулоза – 4-эпимеры.
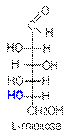
 В качестве стандарта для определения принадлежности соединения к стереохимическому D- или L-ряду принята конфигурация асимметрического атома в простейшей триозе — D-глицериновом альдегиде. Принадлежность соединения стереохимическому ряду определяет конфигурация асимметрического атома углерода с наибольшим номером (в случае глюкозы — атома С5). Если она совпадает с конфигурацией асимметрического атома углерода D-глицеринового альдегида, то соединение относят к D-ряду, если не совпадает — к L-ряду. Установлено, что все природные монозы относятся к D-ряду.
В качестве стандарта для определения принадлежности соединения к стереохимическому D- или L-ряду принята конфигурация асимметрического атома в простейшей триозе — D-глицериновом альдегиде. Принадлежность соединения стереохимическому ряду определяет конфигурация асимметрического атома углерода с наибольшим номером (в случае глюкозы — атома С5). Если она совпадает с конфигурацией асимметрического атома углерода D-глицеринового альдегида, то соединение относят к D-ряду, если не совпадает — к L-ряду. Установлено, что все природные монозы относятся к D-ряду.
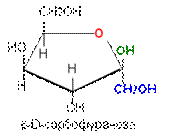
Цикло-оксо-таутомерия моносахаридов. В твердом состоянии и в водном растворе моносахариды преимущественно существуют в виде циклических полуацеталей. Образование полуацеталей можно рассматривать как внутримолекулярную реакцию AN, в результате которой образуются наиболее устойчивые шестичленные циклы (пиранозные) и пятичленные циклы (фуранозные). Таким образом, в растворе устанавливается таутомерное равновесие между открытой (оксо-формой) и циклической формой моносахарида, причем циклическая форма значительно преобладает (более 99,9 % в равновесной смеси):
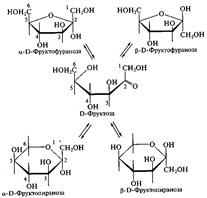
Для изображения на плоскости пространственной структуры соединений в открытой форме используют проекционные формулы Фишера, а для изображения на плоскости пространственной структуры циклических соединений применяют проекционные формулы Хоуорса:
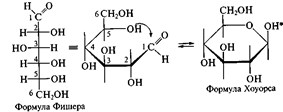
При этом руководствуются следующими правилами: цикл изображают плоским; заместители, находящиеся в оксо-форме справа, изображают под плоскостью цикла, а находящиеся слева — над плоскостью цикла; атомы водорода связей С—Н могут быть не показаны.
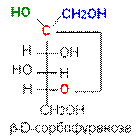
 В циклической форме появляется дополнительный по сравнению с открытой формой асимметрический атом углерода (центр хиральности): атом С1 в альдозах или атом С2 в кетозах, называемый аномерным атомом углерода, и дополнительная группа –ОН, называемая полуацеталъным гидроксилом (в формуле Хоуорса показана звездочкой *). Если конфигурация аномерного атома углерода совпадает с конфигурацией атома, определяющего принадлежность соединения стереохимическому ряду, его называют a-аномером, если не совпадает — b-аномером.
В циклической форме появляется дополнительный по сравнению с открытой формой асимметрический атом углерода (центр хиральности): атом С1 в альдозах или атом С2 в кетозах, называемый аномерным атомом углерода, и дополнительная группа –ОН, называемая полуацеталъным гидроксилом (в формуле Хоуорса показана звездочкой *). Если конфигурация аномерного атома углерода совпадает с конфигурацией атома, определяющего принадлежность соединения стереохимическому ряду, его называют a-аномером, если не совпадает — b-аномером.
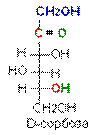 |  |
Таким образом, a- и b-аномеры моноз можно рассматривать как изомеры положения полуацетального гидроксила. Переход аномерных форм a « b осуществляется только через открытую оксо-форму: a-форма « оксо-форма « b-форма
Аналогично устанавливается равновесие в растворе между пиранозными и фуранозными формами. Преобладание a- или b-аномера зависит от природы монозы, растворителя, концентрации и других внешних условий. Равновесие между всеми формами является, таким образом, динамическим. Так, если какой-либо аномер глюкозы растворить в воде, он постепенно превращается в другой аномер, пока не образуется равновесная смесь двух аномеров, в которой также содержится очень небольшое количество открытой формы. Этот переход сопровождается изменением оптического вращения раствора. Такое явление называют мутаротацией (аномеризацией) моносахаридов. Равновесная смесь, образующаяся в результате мутаротации как a-, так и b-D-глюкопираноз, содержит 36 % a-изомера и 64 % b-формы. Доля оксо-формы в равновесной смеси невелика (при рН 6,9 равновесная смесь D-глкжозы содержит лишь малую часть альдегидной формы). Поэтому монозы не дают характерного для альдегидов окрашивания в реакции с фуксиносернистой кислотой и не реагируют с гидросульфитом натрия. Мутаротация катализируется кислотами и основаниями. В твердом состоянии монозы находятся исключительно в циклической форме.
Химические свойства моносахаридов. В химическом отношении монозы сочетают в себе свойства многоатомных спиртов, карбонильных соединений и полуацеталей.
Дата добавления: 2014-04-05; просмотров: 919; Нарушение авторских прав

Мы поможем в написании ваших работ!