
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Исторический обзор возникновения и эволюция создания тугоплавких неметаллических и силикатных материалов. Современные направления науки в разработке и создании твердых материалов
Человечество всегда окружали твердые тела. Это камни и скалы, кремень и кость, керамика и железо, золото и алмаз. Не случайно название самой древней эпохи в истории человечества «палеолит» происходит от корня «лит» (греч. litos – камень).
Первым искусственным твердым материалом является обожженная глина и изделия из нее, которые получили название керамика (от греч. keramike – искусство изготовления изделий из глины). Первые упоминания о керамике относятся к XIV тысячелетию до н.э. Археологические раскопки, проводимые на территории многих стран Европы, Азии, Африки, Америки, дают обширный материал для изучения этой интереснейшей области творческой деятельности человека. Наличие легкодоступного материала – глины – обусловило раннее и практически повсеместное развитие керамического ремесла.
| Рис.1. Терракотовая армия |
 Так, например, в Китае в провинции Лао Цзы была обнаружена гробница императора Цинь Шихуанди, которую относят к III тысячелетию до н.э. Согласно преданию, император не хотел отказываться от трона и после смерти. В мир иной его сопровождали 8 тысяч глиняных солдат, вылепленных в полный рост. Каждая фигура являлась портретом реального человека, имела различия в чертах и выражениях лиц, а также антропологические особенности (рис.1).
Так, например, в Китае в провинции Лао Цзы была обнаружена гробница императора Цинь Шихуанди, которую относят к III тысячелетию до н.э. Согласно преданию, император не хотел отказываться от трона и после смерти. В мир иной его сопровождали 8 тысяч глиняных солдат, вылепленных в полный рост. Каждая фигура являлась портретом реального человека, имела различия в чертах и выражениях лиц, а также антропологические особенности (рис.1).
Символические воины Цинь Шихуанди были сделаны из терракоты – материала, название которого включает в себя два понятия: «земля», «глина» (terra) и «обжиг» (cotta).
Особое место в истории занимает керамика античной Греции. Ее расцвету предшествовало развитие гончарного дела на острове Крит, одного из ведущих центров Эгейской культуры (рис.2). В Древней Греции керамика применялась также для выполнения кровель и украшения фасадов. Первый храм Геры в Олимпии (VII век до н.э.) имел черепичную крышу и украшения из терракоты. Археологами обнаружены остатки зданий и сооружений из керамического кирпича в Древнем Египте и Ассирии, датируемые III–I тысячелетием до н.э.
Производство наиболее ценного вида керамики – фарфора – появилось значительно позже, хотя секретами его получения в Китае владели еще в 2000 г. до н.э. В Европу впервые китайский фарфор привез известный путешественник Марко Поло в конце XIII века.
| Рис.2. Рабочий процесс античных мастеров |
Наибольшего расцвета гончарное производство достигло в XV веке в Италии, куда эта техника попала из мавританской Испании через остров Мальорку, от названия которого произошёл термин «майолика». Параллельно с майоликой с XVI века появляется фаянс, технология изготовления которого была разработана в одном из городов Италии – Фаэнце. Итальянская майолика оказала заметное влияние на ее развитие в других европейских странах, в первую очередь в Германии и Франции. Первое европейское фаянсовое производство появилось во французском городке Сен-Поршер. В XVI-XVII веках производство майолики и фаянса быстро распространилось во Франции, Германии, Голландии, Англии.
Фарфор, завозимый в то время венецианскими и португальскими купцами, значительно превосходил все известные европейцам керамические изделия по белизне, просвечиваемости, твердости, богатству красок, ценился очень дорого и был предметом роскоши. Керамисты Франции и Англии, не находя разгадки «китайского секрета», создали поначалу свои разновидности фарфоровидной керамики – мягкий фриттовый и костяной фарфор.
Настоящий «твердый» фарфор был получен в начале XVIII века в Германии. В саксонском городе Мейсене против главного здания Мейсенского фарфорового завода стоит памятник Иоганну Бетгеру, с именем которого связано овладение технологией изготовления фарфора. Секрет изготовления «бетгеровского фарфора» тщательно сохранялся, фарфоровое производство было размещено в верхних этажах королевского замка Альбрехтсбург и выйти из мастерских можно было только через личные покои короля Августа. Бетгер находился на положении самого настоящего узника и умер в 1719 г., так и не получив свободы.
Стекло является одним из важнейших искусственных материалов, прочно вошедших в быт, культуру и технику людей всего мира.
Естественное стекло известно человеку с древнейших времён. Наконечники стрел, ножи, бритвы, зеркала и т. п., изготовленные первобытным человеком из природного вулканического стекла (обсидиана), были найдены в самых различных местах земного шара.
Первые сведения о получении человеком силикатного стекла относятся к IV-III тысячелетию до н. э. Существует несколько легенд, толкующих возможные версии появления технологии стекла. Одна из них гласит, что однажды финикийские купцы на песчаном берегу, за неимением камней, сложили очаг из перевозимой ими африканской соды, а утром на месте кострища они обнаружили стеклянный слиток. Наибольшего расцвета производство стекла достигло в Египте в 1550‑1350 гг. до н. э., когда центром стеклоделия становится тогдашняя столица египетского государства Фивы. В одной из пирамид древнего Египта была обнаружена фреска, изображающая стеклоделов этой страны за работой. Создание этой пирамиды, а, следовательно, и фрески относится к XIVвеку до н. э. На ней изображены два сюжета рабочего процесса античных мастеров, раскрывающих технологию того времени, вернее, её заключительной стадии (рис.3). На левой части фрески чётко виден очаг, в котором разогревают стеклянные заготовки и подвергают их огневой полировке. На рисунке хорошо видно, как один мастер держит во рту трубку, на конце которой находится стеклянный пузырь. На правой части фрески мастер раскатывает заготовку и готовится сделать из неё сосуд.
| Рис.3. Фрагмент фрески Древнего Египта |
В древнейшие времена в Египте стеклянные изделия изготовляли пластическим формованием из горячей вязкой стекломассы. Очень рано стало известно также прессование стекла.
Коренное изменение в производстве стекла произошло на рубеже нашей эры, когда были решены две важнейшие проблемы стеклоделия – варка прозрачного бесцветного стекла и формование изделий с помощью стеклодувной трубки.
Затем стеклоделие стало быстро развиваться в Венеции, и в IX веке она уже конкурирует с Константинополем, вытесняя византийское стекло с местного рынка. Значительный толчок к дальнейшему развитию венецианское стеклоделие получило в 1204 г., после взятия Константинополя крестоносцами, в числе которых были и венецианцы. Насильственные переселения константинопольских стеклоделов в Венецию усилили ее собственное производство и ослабили конкурента. Венеция становится мировым центром стеклоделия и сохраняет свое значение до XVI–XVII веков.
Будучи сильнейшей морской державой Средиземного моря, Венеция вела обширную торговлю со странами Ближнего Востока и Запада, очень видную статью которой составляло стекло. Венецианские стеклянные изделия отличались разнообразием и большой художественной ценностью.
В 1291 г. все стеклоделы были переселены на остров Мурано (в 2 кмот Венеции) под предлогом пожарной безопасности, а на самом деле – для лучшего наблюдения за ними. Стеклоделам было запрещено покидать пределы Венецианской республики. Выдача профессиональной тайны каралась смертью. Техника стеклоделия этого периода известна по трудам Георгия Агриколы. Особый интерес для истории стеклоделия представляет труд флорентийского монаха Антонио Нери, опубликованный в 1612 г. во Флоренции.
Первые листовые стекла получали, разрезая и распрямляя стеклянные цилиндры (т.н. «халявы»), формуемые выдуванием. В XVII веке началось производство листового зеркального стекла отливкой на медные плиты. Массовое производство листового стекла большого размера стало возможным в конце XIX – начале XX века, когда появились большие ванные печи и новые методы выработки стекла.
Вяжущие вещества и материалы на их основе – древнейшие строительные материалы. Первые искусственные вяжущие – строительный гипс, а затем известь – использованы при строительстве уникальных сооружений: бетонной галереи египетского лабиринта (3600 лет до н.э.), фундаментов древнейших сооружений в Мексике, римского Пантеона, перекрытого бетонным куполом диаметром 42,7 м.
Известь и гидравлические добавки применяли на территории всех стран находившихся под римским владычеством, а также в других странах древнего мира, например в Индии, где большее распространение получила известь в смеси с «сурки» (молотым кирпичом). После распада Римской империи, в эпоху раннего средневековья, в Западной Европе многое из римского опыта было утрачено и качество растворов резко ухудшилось. И лишь в XII веке наметился некоторый подъем строительства, а следовательно, и производства вяжущих материалов.
В Киевской Руси строительное искусство было на высоком уровне. Начиная с X века строились каменные, в основном культовые и оборонительные сооружения. Русские строители, осваивая опыт древних, пришедший вместе с христианством из Византии, творчески применяли его в местных условиях. Известковые растворы с гидравлической добавкой в виде молотого кирпича («цемянки») использовали при строительстве Киева, Новгорода, Пскова, Суздаля, Ростова. Были воздвигнуты такие величественные памятники архитектуры, как Софийский собор, Золотые ворота в Киеве и другие, сохранившиеся до наших дней.
Уже в конце XVII – в начале XVIII века в России наряду с белой (воздушной) известью, используемой в основном для штукатурных работ при кладке фундаментов, стен, сводов и других сооружений, начали широко применять серую (гидравлическую) известь.
На Западе смесь извести с гидравлической добавкой, унаследованная от римлян, оставалась основным гидравлическим вяжущим почти до конца XVIII века, а затем наступил перелом, связанный с общим подъемом строительных работ.
Так, например, Англия, одна из могущественных морских держав, не имела своих гидравлических добавок. Поэтому, когда Джон Смит получил задание построить взамен сгоревшего деревянного маяка каменный на Эддистонской скале близ порта Плимут, он попытался найти водостойкие вяжущие из местного сырья. Исследуя известь из различных известняковых пород, Смит пришел к выводу: несмотря на то, что из глинистых известняков получается плохая и медленногасящаяся известь, изделия на ее основе являются достаточно водостойкими. В 1757 г. из гидравлической извести и был воздвигнут маяк. Следующим шагом в разработке гидравлических вяжущих были исследования Джеймса Паркера, который в 1796 г. получил патент на романцемент – продукт обжига глинистых мергелей. Изобретение цемента приписывают английскому каменщику Д. Аспдину, получившему в 1824 г. патент на изготовление вяжущего вещества обжигом смеси извести с глиной. За сходство по цвету с естественным камнем из каменоломен вблизи г. Портлэнд в Англии, он назвал это вяжущее портландцементом. Однако Аспдин не обжигал смесь до спекания (частичного плавления), поэтому полученное им вяжущее по технологии и свойствам являлось разновидностью романцемента и, следовательно, не походило на современный портландцемент.
На Руси силикатные материалы появились в IX – X веках в домонгольский период: стекло – в основном в виде украшений и сосудов; керамика – в виде посуды, игрушек, украшений, плиток для полов.
Развитие производства вяжущих материалов было связано со строительством древних городов (Киев, Новгород, Псков, Москва и др.). Известковый раствор использовался в X веке при сооружении Десятинной церкви в Киеве, в XI веке – Коложской церкви в г. Гродно. На извести в XV веке были сложены стены московского Кремля.
Татаро-монгольское нашествие надолго затормозило развитие Руси, в том числе и развитие технологий силикатных материалов. В возрождении этих производств особая роль отводится Москве. Центром керамических ремесел стала Гончарная Слобода в районе Таганки, где производили посуду, игрушки и даже музыкальные инструменты. Первый стекольный завод на Руси был построен под Москвой в селе Духанино в 1635 г., а в 1668 г. в селе Измайлово – второй стекольный завод, принадлежащий лично царю Алексею Михайловичу. Затем количество стекольных заводов значительно выросло: в 1760 г. – 25, в 1804 г. – 150, в 1883 г. – 196, в 1913 г. – 275.
В 1584 г. Иваном Грозным был создан Каменный приказ, который ведал заготовкой камня, выпуском кирпича, производством извести.
В 1853 г. в России построен первый завод по производству портландцемента производительностью около 4000 тонн в год. Затем осуществился запуск заводов в Риге (1866 г.), Щурове (1870 г.), Пунане-Кунда (1871 г.), Подольске (1874 г.), Новороссийске (1882 г.), Глухозерске близ Петербурга (1887 г.), Амвросиевке (1896 г.), Вольске (1897 г.) и т.д.
К 1910 г. в России насчитывалось около 30 цементных заводов общей мощностью около 1 млн. т цемента в год. В Беларуси первый завод запущен в г. Волковыске (1914 г.).
Российские ученые внесли весомый вклад в развитие всех ветвей технологии силикатных материалов. В стеклоделии важнейшие теоретические разработки принадлежат М.В. Ломоносову. В 1735 г. он основал Усть-Рудницкую стекольную фабрику, где всего за три года провел 2184 опытные плавки стекла, «коих не токмо рецепты сочинял, но и материал своими руками развешивал и в печь ставил…». Изобретателем русского фарфора (1745 г.) и основателем первого фарфорового завода был Д.Н. Виноградов. Огромная заслуга в создании портландцемента принадлежит Е.Г. Челиеву, который независимо от английских ученых в 1825 г. обобщил опыт улучшения свойств вяжущих материалов, накопленный при восстановлении уничтоженной пожаром Москвы после войны 1812 г. и впервые стал изготавливать цемент из смесей извести или известковой штукатурки с глиной, производя их обжиг до частичного расплавления компонентов с последующим измельчением полученного продукта.
В настоящее время тугоплавкие неметаллические и силикатные материалы – это сотни тысяч продуктов и изделий, без которых нельзя себе представить наш быт и работу всех отраслей промышленности. С ними связывают перспективы дальнейшего научно-технического прогресса. Среди современных направлений развития науки в области синтеза и исследования тугоплавких неметаллических и силикатных материалов можно выделить следующие:
– создание высокопрочных материалов (прочность свыше 104 МПа) – материалы на основе твердых сплавов, карбиды, бориды, технические ситаллы, которые могут найти применение в машиностроении, авиастроении, металлургии и т.д.;
– уменьшение эффективной массы изделий за счет создания новых конструкционных материалов – крупногабаритные пустотелые стеновые материалы, легкие заполнители бетонов для силовых конструкций, эффективные газосиликатные изделия;
– создание новых видов тепло- и звукоизоляционных материалов, обеспечивающих аккумуляцию и сохранение тепла внутри помещений или препятствующих теплопередаче через ограждающие конструкции сооружений;
– создание антифрикционных материалов, способных обеспечить низкий коэффициент трения скольжения и, как следствие, малую скорость изнашивания узлов и деталей;
– создание материалов медицинского назначения, которые могут применяться в костной и челюстно-лицевой хирургии при изготовлении биоимплантантов; при протезировании (металлокерамика) и лечении (стоматологические цементы) в стоматологии;
– разработка технологий и материалов повышенной водостойкости на основе вяжущих веществ, которые могут найти применение как для обустройства и защиты фасадов зданий, так и при возведении подземных тоннелей и надводных сооружений;
– создание термостойких и высокотемпературопрочных материалов, способных выдерживать воздействие резкого перепада температур и работать в условиях глубокого холода или повышенного теплового воздействия;
– создание новых видов полупроводниковых материалов по планарной технологии изготовления микроэлектроники. Суть этой технологии заключается в том, что различные элементы микросхем изготавливаются путем соединения слоев керамических и токопроводящих материалов в так называемый «слоеный пирог» или чип;
– создание наноразмерных и наноструктурированных материалов и продуктов на их основе, которые могут найти применение в самых разнообразных областях промышленной индустрии: биотехнологии, микроэлектроники, химической промышленности, машиностроении, атомной энергетики, авиакосмической технике и т. д.
“Природа так обо всем позаботилась,
что повсюду ты находишь чему учиться”
Леонардо да Винчи
ТЕМА 2. Общая характеристика и основные свойства твердых материалов. Классификация тугоплавких неметаллических и силикатных материалов
В общем случае твердыми материалами называют вещества, отличающиеся постоянством объема и формы, имеющие следующие характерные черты:
– упругость формы – способность материала восстанавливать внешнюю форму тела после прекращения действия деформирующих сил;
– наличие значительных сил связи между частицами, которые позволяют им совершать колебательные движения около некоторых состояний равновесия, но не допускают поступательных движений;
– правильное пространственное расположение частиц кристалла, определяющее анизитропность его свойств и позволяющее ввести понятие кристаллической решетки – неподвижного каркаса, узлы которого соответствуют положениям равновесия частиц;
– скачкообразное изменение физических свойств при плавлении.
В зависимости от агрегатного состояния и устойчивости твердые вещества могут иметь строго упорядоченное строение – кристаллическое, или неупорядоченное, хаотическое строение – аморфное.
Упорядоченное расположение частиц в кристалле сохраняется на больших расстояниях, а в случае идеально образованных кристаллов – во всем объеме материала. Такая упорядоченность строения твердых тел носит название дальний порядок.
В телах с менее упорядоченным или хаотичным расположением частиц, что свойственно аморфным телам, имеет место лишь местная упорядоченность, которая не распространяется дальше определенной совокупности частиц. В этом случае говорят, что имеет место ближний порядок.
Схематическое расположение атомов кремния и кислорода в кристаллическом и аморфном кварце представлено на рис. 4.
Хаотичность расположения частиц свидетельствует о неустойчивом агрегатном состоянии системы, способном изменяться как под действием внутренних, так и внешних факторов. Аморфные тела, например, не имеют постоянной точки плавления. Поведение кристаллических и аморфных веществ при нагревании представлено на рис. 5.
| Рис. 5. Характер поведения аморфных (а) и кристаллических (б) веществ при нагревании |
| |
| Рис. 4. Схематическое расположение атомов кремния и кислорода в кристаллическом (а) и аморфном (б) кварце |
Кристаллические материалы анизотропны, характеризуются наличием определенной геометрической формы и определенной температуры плавления, при которой вещество переходит в жидкое состояние. Они могут встречаться как в виде отдельных кристаллов – монокристаллы, так и в виде скоплений мелких кристаллов – поликристаллы. Монокристаллы растут в виде правильных многогранников, форма которых определяется симметрией и закономерным внутренним строением.
Аморфные вещества характеризуются двумя особенностями. Во-первых, свойства таких веществ при обычных условиях не зависят от выбранного направления, т.е. они изотропны. Во-вторых, при повышении температуры происходит размягчение аморфного вещества и постепенный переход его в жидкое состояние. Точное значение температуры плавления отсутствует.
Общим для кристаллического и аморфного состояний веществ является отсутствие поступательного перемещения частиц и сохранение только их колебательного движения около положения равновесия. Различие между ними состоит в наличии геометрически правильной решетки у кристаллов и отсутствии дальнего порядка в расположении атомов у аморфных веществ.
Аморфное состояние вещества, по сравнению с кристаллическим, всегда менее устойчиво и обладает избыточным запасом внутренней энергии. В связи с этим, при определенных условиях, самопроизвольно осуществляется переход из аморфного состояние в кристаллическое.
Твердые тела в аморфном состоянии можно получить двумя путями. Первый путь – быстрое охлаждение расплавов кристаллических веществ, преимущественно ионного и ковалентного строения. Типичный представитель таких аморфных тел – силикатные стекла, битумы, смолы и др.
Второй путь – диспергация кристаллических структур. В результате диспергации кристаллических тел образуются аморфизованные дисперсии в виде коллоидов и растворов. Разрушаясь или конденсируясь, дисперсии изменяют свое агрегатное состояние. Пересыщенные растворы, например, могут превратиться в гель и образовать полимер или кристаллизоваться.
Аморфные вещества подразделяют на витроиды (стекла), дисперсные системы и полимеры.
Витроиды – это твердые тела в аморфном состоянии, имеющие стекловидную структуру. Как уже отмечалось, стекла образуются в результате быстрого охлаждения, преимущественно силикатных расплавов. Быстрое охлаждение препятствует созданию упорядоченной структуры. Особенно, если молекулы громоздки, а скорость охлаждения велика.
Дисперсные системы – мельчайшие частицы размером 10-7 - 10-9 м. К ним относятся коллоиды, золи (органозоли, гидрозоли), пасты, клеи, мастики, краски, латексы и др. К дисперсным аморфным системам относятся также некоторые горные породы (диатомит, опоки), имеющие общую формулу SiO2.nH2O; а также активный кремнезем, образуемый в результате разложения глин при их нагревании.
Полимеры – вещества, характерной особенностью которых является большой размер и большая молекулярная масса молекул. Кроме того, молекулы объединены в структурные единицы, включающих 103-105 молекул-мономеров.
Классификация тугоплавких неметаллических и силикатных материалов разделяет их на три группы:
1. Стекло и стеклоизделия.
2. Керамические материалы.
3. Вяжущие вещества и материалы на их основе.
Стекло – аморфные тела, полученные путем переохлаждения расплава и обладающие в результате постепенного увеличения вязкости механическими свойствами твердых тел. Характерным является то, что переход из жидкого состояния в стеклообразное является обратимым.
Прозрачность и возможность окраски стекла в любые цвета, высокая химическая стойкость, достаточно высокая прочность и твердость, электроизоляционные и многие другие ценные свойства делают стекло незаменимым строительным материалом. Его используют не только для сооружения светопрозрачных конструкций (окон, витражей, фонарей), но и как конструкционный и отделочный материал. В современном строительстве высотные здания часто имеют фасады, полностью выполненные из стекла с улучшенными декоративными, светоотражающими и теплозащитными свойствами. Кроме этого, из стекла получают различные стеклоизделия (блоки, трубы, стеклопрофилит), эффективные теплоизоляционные материалы (пеностекло и стеклянную вату), а также стекловолокно и стеклоткани.
Важнейшими сырьевыми материалами для производства стекла являются кварциты, кварцевый песок, агат, яшма, опал, трепел, диатомит, песчаник, жильный кварц, полевые шпаты, флюорит, касситерит, пегматиты, лепидолиты, сподумен, известняк, мрамор, доломит, гематит, мел, магнезит и др.
Необходимо отметить, что на процесс стекловарения расходуется много энергии (температура варки 1500–1580 ºС) и при этом в атмосферу поступает много вредных выбросов. Поэтому и экологически, и экономически целесообразно вырабатывать стеклоизделия из вторичного сырья (стеклобоя, стеклянной посуды и т. п.). Это оценили в большинстве стран Западной Европы, где до 80 % стекла получают именно таким образом.
В зависимости от назначения выделяют следующие виды стекла:
– листовое стекло – основной вид стекла, применяемый в строительстве и используемый для остекления оконных и дверных проемов, витрин и т. п. Наряду с этим все шире развивается выпуск листового стекла со специальными свойствами, например, теплопоглощающего, светоотражающего, увиолевого, защитного, декоративного, а также изделий на его основе: стеклопакеты и стеклопрофилит;
– тарное стекло предназначено для изготовления стеклянной тары и упаковки. Стекло для тары может быть бесцветным, необеспеченным (полубелым), окрашенным в темно-зеленый, оранжевый и другие цвета. В основном стеклянную тару получают выдуванием и пресс-выдуванием стекломассы на полуавтоматах и на автоматах;
– сортовое стекло – изделия из бесцветных, хрустальных и окрашенных стекол, употребляемые в быту, культурно-бытовых учреждениях и т.д. Различают следующие виды: бытовая посуда, посуда для напитков, художественно-декоративные изделия;
– техническое стекло – закаленное стекло, армированное, безосколочное многослойное ламинированное стекло (триплекс);
– стеклянные трубы и трубки благодаря высокой химической стойкости, гладкости поверхности и прозрачности с успехом соперничают с металлическими. В ряде областей (например, химическая и пищевая промышленность) их применение предпочтительнее. Пропускная способность стеклянных труб на 5–10 % выше, чем стальных при одинаковом диаметре;
– электровакуумное и электротехническое стекло применяется для изготовления ламп накаливания;
– химико-лабораторное стекло обладает высокой химической и термической устойчивостью и используется для изготовления химико-лабораторной посуды и аппаратуры;
– медицинское стекло применяется для хранения лекарственных препаратов;
– оптическое стекло применяют для изготовления линз, призм, кювет и др.;
– архитектурно-строительное стекло: стеклоблоки – вырабатываются из горячей стекломассы на пресс-автоматах, формующих половинки блоков, а затем сваривающих их; пеностекло – блоки из вспученного в момент нахождения в расплавленном состоянии стекла, которые по структуре и свойствам напоминают вулканическую пемзу и используются как теплоизоляционный материал;
– стекловолокно – получают путем продавливания стекольного расплава через тончайшие фильеры (отверстия в твердых материалах) споследующей вытяжкой и намоткой на бобины. Из стекловолокна получают стеклянные ткани и стекловойлок, которые используют как армирующий компонент при производстве стеклопластиков или в качестве основы в рулонных кровельных и гидроизоляционных материалах.
Ситаллы – материалы, получаемые на основе стекла путем направленной регулируемой объемной кристаллизации. Количество кристаллической фазы в ситалле может колебаться в пределах 10–90 %, что обеспечивает им повышенную термостойкость, прочность, тугоплавкость, электроизоляционные и радиотехнические свойства.
Керамика – собирательное название широкой группы искусственных каменных материалов, получаемых формованием из глиняных смесей с минеральными и органическими добавками с последующей сушкой и обжигом.
Простота технологии и неисчерпаемая сырьевая база для производства керамических изделий самых разнообразных видов предопределили их широкое и повсеместное распространение. Этому способствовали также высокая прочность, долговечность и декоративность керамики. И в настоящее время керамика остается одним из основных строительных материалов, применяемых практически во всех конструктивных элементах зданий и сооружений.
Сырьевая масса для изготовления керамических материалов состоит из пластичных материалов (глин) и непластичных (отощающих и выгорающих добавок, плавней и др.). Глины обеспечивают получение удобоформуемой связной массы и после обжига прочного и водостойкого черепка. Непластичные добавки улучшают технологические свойства сырьевой массы (облегчают сушку, уменьшают усадку и снижают температуру обжига) и придают материалу желаемые свойства (пористость, теплопроводность и т. п.).
По назначению керамические изделия делят на следующие виды:
– стеновые материалы применяют в основном для кладки стен зданий, изготовления сборных стеновых панелей, кладки печей и дымовых труб (керамический кирпич и камень);
– тонкая керамика включает изделия, имеющие плотный спеченный или микропористый черепок покрытый глазурью. Сюда входят все виды фарфоровых, тонкокаменных, полуфарфоровых, фаянсовых и майоликовых изделий, основными свойствами которых являются прочность, твердость, термо- и химическая стойкость, цвет и водопоглощение;
– кровельные материалы используют для обустройства крыш малоэтажных зданий. Керамическая черепица обладает целым рядом уникальных свойств (долговечность, стойкость к атмосферным воздействиям, легкость монтажа и ремонта, экологическая безопасность) и многообразием цветовых решений;
– изделия для облицовки фасадов включают в себя лицевой кирпич, крупноразмерные облицовочные плиты и архитектурные детали (терракоту) и плитки различных размеров;
– изделия для внутренней облицовки представлены керамической плиткой для стен и полов, используются для обустройства ванных комнат, санитарных узлов, кухонь и др., отличаются уникальным сочетанием эксплуатационных свойств, декоративных и гигиенических характеристик;
– санитарные керамические изделия изготавливают из твердого фаянса, фарфора или полуфарфора, ассортимент включает умывальники, унитазы, ванны, писуары, биде и канализационные трубы. Они покрываются глазурью изнутри и снаружи, отличаются универсальной устойчивостью к действию различных сред и достаточной механической прочностью.
– специальная керамика (кислотоупорная, огнеупорная и теплоизоляционная). Кислотоупорная керамика предназначена для футеровки реакционных аппаратов и котлов, для защиты строительных конструкций, работающих в условиях кислых агрессивных сред, а также для футеровки дымовых труб, которые служат для отвода газов, содержащих агрессивные вещества. Огнеупорные изделия применяют для строительства промышленных печей, топок и аппаратов, работающих при высокой температуре. Теплоизоляционная керамика используется для
– заполнители для легких бетонов: керамзит – гранулированный пористый материал, имеющий в изломе структуру застывшей пены, получаемый на основе легкоплавких вспучивающихся глин; аглопорит – искусственный пористый материал на основе глинистых сланцев и суглинков, получение пористой структуры достигается введением выгорающих добавок.
– техническая керамика – это керамика на основе высокоогнеупорных оксидов или соединений (муллитовая, муллито-корундовая, кордиеритовая, цирконовая, на основе шпинелей и хромитов, на основе тугоплавких неметаллических соединений: карбиды, нитриды, бориды).
Минеральные вяжущие вещества – порошкообразные вещества, образующие с водой пластичную массу, способную со временем затвердевать в прочное камнеподобное тело.
Вяжущие материалы делят на 4 группы:
1. Воздушные вяжущие – материалы, способные после затворения с водой твердеть и сохранять прочность только на воздухе (известковые, гипсовые и магнезиальные вяжущие);
2. Гидравлические вяжущие – материалы, способные после затворения с водой твердеть и сохранять прочность на воздухе и в воде (портландцемент, глиноземистый цемент и др.);
3. Вяжущие автоклавного твердения – материалы, способные после затворения с водой твердеть и набирать прочность только в автоклаве при обработке чистым паром под давлением 0,9–1,3 МПа и температуре 167–198 ºС (известково-кремнеземистые смеси, низкоосновные силикаты кальция);
4. Кислотоупорные вяжущие – материалы, способные после затворения с водой твердеть и сохранять прочность при хранении в растворах кислот (кислотоупорный цемент, кварцевый кремнефтористый цемент).
На основе вяжущих веществ получают целый ряд материалов и изделий. Так, на основе гипсовых вяжущих получают гипсокартонные листы, гипсовые и гипсобетонные панели, на основе известковых – газосиликатные блоки и силикатный кирпич, на основе портландцемента – строительные растворы и сухие смеси, бетон и железобетон, асбестоцементные изделия и т.д.
«Всякий кристалл, как и все существующее в природе,
претерпевает со временем ряд изменений,
составляющий то, что условно называют его жизнью»
А.В.Шубников
ТЕМА 3. Особенности строения твердых материалов
В общем случае под строением понимается совокупность устойчивых связей тела, обеспечивающих его целостность. Такое определение является достаточно общим и в этой связи выделяют три уровня строения твердых материалов:
– микроструктура;
– макроструктура;
– текстура.
При характеристике микроструктуры выделяют два ее уровня: атомная структура идеальных кристаллов, определяющая их физические свойства и дефектная структура реальных кристаллов, учитывающая неоднородность их строения.
Макроструктура твердых материалов определяется элементами структуры, видимыми невооруженным взглядом или при небольшом увеличении (5–6 раз). Основу макроструктуры составляют зерна размером выше 0,1 мм. В зависимости от размера зерен макроструктуру делят на три группы: крупнозернистая – зерна более 5 мм; среднезернистая – 1–5 мм; мелкозернистая – менее 1 мм.
Текстура материала – это преимущественно ориентированное расположение элементов, составляющих материал, характеризующих рисунок его внутренних слоев или поверхности. Текстура, в отличие от структуры, не имеет такой логической связи с составом, химическими связями и свойствами и является дополнением к более широкому понятию – «структура материала». Текстура материала определяется формой зерен и пор в материале, их размерами, объемом и взаиморасположением. Например, для уточнения характера структуры применяют термины «волокнистая», «зернистая», «чешуйчатая» текстуры.
Строение идеальных кристаллических твердых телосновано наприроде частиц, находящихся в узлах кристаллической решетки и преобладающих силах взаимодействия между ними, которые определяют характер кристаллической решетки: атомный с ковалентными связями, молекулярный с ван-дер-ваальсовыми и водородными связями, ионный с ионными связями, металлический с металлическими связями.
Любое кристаллическое твердое тело образуется из отдельных атомов только в том случае, если это энергетически выгодно.
| Рис. 6. Схема силового взаимодействия между разноименно заряженными частицами |
В состоянии, когда r > r0 между атомами преобладают силы притяжения, которые сближают частицы.
При r < r0 электронные оболочки атомов начинают взаимно проникать одна в другую, при этом возникают силы отталкивания вследствие взаимодействия положительных зарядов.
Кристалл является наиболее стабильным при минимальных значениях результирующей силы U – энергия связи, [кДж/моль]. Такое состояние называют потенциальной ямой.
Под энергией связи понимают энергию, которую необходимо затратить для полного расчленения материала на его составляющие частицы (атомы, ионы, молекулы). Энергия связи определяет основные свойства материалов, такие как температура плавления, модуль упругости, температурный коэффициент линейного расширения.
Значения энергии связи для различных материалов приведены в табл. 1.
Таблица 1
| Кристалл | Ar | CH4 | Алмаз | SiC | LiF | NaCl | Fe | Na |
| Энергия связи, кДж/моль | 7,5 | |||||||
| Тип связи | Ван-дер-Ваальсовская | Ковалентная | Ионная | Металлическая |
Значения энергии связи различных кристаллических веществ
В зависимости от физической природы сил, действующих между частицами, кристаллы можно разделить на 4 группы: ионные, ковалентные, молекулярные, металлические.
Молекулярные кристаллы – это твердые тела, в узлах кристаллических решеток которых располагаются либо одинаковые молекулы с насыщенными связями (H2, Cl2, Br2, I2), либо атомы инертных газов (Ar, Ne, Kr, Xe, Rn). Одной из особенностей молекулярных кристаллов является то, что частицы в кристалле удерживаются очень слабыми силами Ван-дер-Ваальса.
Каждый атом таких кристаллов имеет полностью достроенные электронные оболочки, поэтому при их сближении обмен электронами невозможен. Происходит перераспределение зарядов – поляризация; после между перераспределенными зарядами возникают силы притяжения. С каждым из соседних атомов образуется мгновенный диполь.
| Рис. 7. Схема строения молекулярных кристаллов |
Энергия связи сил Ван-дер-Ваальса очень маленькая и составляет 0,02–0,1эВ, поэтому молекулярные кристаллы обладают низкой температурой плавления, низким модулем упругости, высоким температурным коэффициентом линейного расширения (ТКЛР) и чаще всего представляют собой диэлектрики.
Ковалентные кристаллы– это твердые тела, кристаллическая структура которых образована за счет ковалентной связи. Их образуют элементы IV, V, VI групп побочных подгрупп периодической системы (С, Si, Ge, Sb, Bi и др.).
При взаимодействии атомы обобществляют свои валентные электроны с соседними атомами, достраивая, таким образом, валентную зону. Каждая связь образуется парой электронов, движущихся по замкнутым орбиталям между двумя атомами. Число атомов n, с которыми происходит обобщение электронов, зависит от валентности элемента и может быть определено по формуле:
n = 8 – N (1)
где N – валентность элемента.
Например, для углерода n = 4, т.е. атом углерода имеет 4 валентных электрона, посредством которых он образует четыре направленные связи и вступает в обменное взаимодействие с четырьмя соседними атомами.
Особенностью ковалентной связи является ее направленность, вследствие чего атомы в ковалентных кристаллах укладываются некомпактно и образуют кристаллические структуры с небольшим координационным числом. Вследствие больших значений энергии связи на малых расстояниях (4–5 эВ) ковалентные кристаллы характеризуются высокими температурами плавления, низкими, иногда отрицательными, значениями ТКЛР. К ним также относятся сложные вещества, состоящие из разнородных атомов, например карбид кремния, нитрид алюминия и др.
Металлические кристаллы – это твердые тела с преобладанием металлического типа химической связи, который преобладает у элементов главных подгрупп и I–III групп побочных подгруппах.
Металлическая связь осуществляется за счет валентных электронов, слабо связанных атомами.
| Рис. 8. Схема строения металлических кристаллов |
| |
Ионные кристаллыпредставляют собой соединения с преобладающим ионным характером связи, в основе которой лежит электростатическое взаимодействие между двумя заряженными ионами. Типичными представителями ионных кристаллов являются галогениды щелочных металлов и оксиды.
| Рис. 9. Схема строения ионных кристаллов |
| |
Для ионных кристаллов координационное число определяется соотношением радиусов металлических и неметаллических ионов. В решетке атомы укладываются как шары разных диаметров (рис. 10).
| Рис. 10. Схема строения калийной соли |
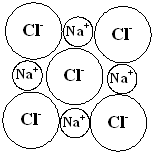 Радиусы неметаллических ионов больше радиусов металлических, поэтому последние заполняют поры в кристаллической решетке, образованной неметаллическими ионами.
Радиусы неметаллических ионов больше радиусов металлических, поэтому последние заполняют поры в кристаллической решетке, образованной неметаллическими ионами.
Энергия связи ионного кристалла по своему значению близка к энергии связи ковалентного кристалла и составляет около 5эВ. В связи с этим, ионные кристаллы имеют высокую температуру плавления и модуль упругости, низкий коэффициент сжимаемости и ТКЛР.
Главная химическая связь в силикатах «Si–O» образуется путем перекрывания гибридных орбиталей кремния с sp3-, sp2-, sp-гибридными орбиталями кислорода, в результате чего образуется четыре ковалентные σ-связи.
Валентные углы O–Si–О, т. е. углы внутри тетраэдра определяются тетраэдрической пространственной конфигурацией атома и равны 109º (рис.11).
| Рис. 11. Структура кремнийкислородного тетраэдра |
| |
В основе структуры силикатов лежит кремнийкислородный тетраэдр [SiO4]4-, в котором ионы кислорода тетраэдрически окружают ион кремния и находятся от него на расстоянии 0,162 нм. Практически во всех соединениях кремний сохраняет координационное число 4. Тетраэдры [SiO4]4- сочленяются друг с другом вершинами, а поскольку тетраэдр имеет четыре вершины, то общими могут быть одна, две, три или все четыре вершины. Это определяет многообразие структур и различное по форме сочетание взаимно связанных тетраэдров, которые называются кремнекислородными мотивами.
В состав природных и технических силикатов, кроме кремния и кислорода, входят и другие элементы, важнейшим из которых является алюминий. Он может содержаться в силикатах в двух формах: в виде катиона (силикаты алюминия) и в составе аниона (алюмосиликаты). Алюминий с координационным число 4 может входить в кремнекислородный мотив, а алюминий с кремнекислородным числом 6 выполняет роль катиона.
Строение реальных кристаллических твердых тел отличается от идеальных нарушениями кристаллической решетки – дефектами (от лат. defectus – недостаток, изъян), которые образуются в результате изменения равновесных условий роста кристаллов, захвата примесей при кристаллизации, а также под влиянием различного рода внешних воздействий.
Различают следующие виды дефектов:
– точечные или нульмерные дефекты характеризуются нарушением структуры, которое сосредоточено в отдельных точках кристалла. Размеры таких дефектов не превышают одного или нескольких межатомных расстояний. К ним относят вакансии, междоузельные атомы, атомы примесей в узлах или междоузлиях и пр.;
– линейные или одномерные дефекты характеризуются тем, что нарушение структуры наблюдается только в одном измерении на расстоянии намного больше параметров кристаллической решетки, тогда как в двух оставшихся измерениях нарушения не превышают одного порядка. К ним относятся дислокации;
– поверхностные или двумерные дефекты в двух измерениях имеют размеры намного больше параметров кристаллической решетки, а в третьем измерении – не более одного порядка. К ним относят границы зерен и двойников, межфазные границы, дефекты упаковки частиц и др.;
– объемные или трехмерные дефекты – микропустоты или включения другой фазы, развитые в трех направлениях (поры и трещины).
Точечные дефектыподразделяются на энергетические, электронные и атомные.
К энергетическим дефектам относят фононы – кванты тепловых колебаний, которые заполняют кристаллы и распределяются в них соответственно условиям теплового равновесия. К этому же типу дефектов относят возбуждения решетки в результате облучения кристаллов световыми, рентгеновскими и прочими лучами.
| Рис. 12. Виды точечных дефектов |
| |
К атомным дефектам относят нарушения в виде вакансий или отсутствия атома в решетке (рис. 12, а), дефектов замещения, когда примесный атом другой природы занимает позицию «нормального, родного» атома (рис. 12, b) и междоузельных атомов – избыточных атомов, расположенных в незанятых позициях кристаллической решетки избытка или недостатка атомов (рис. 12, c).
Точечные дефекты могут появляться при повышенных температурах в твердых телах – тепловые дефекты; при облучении быстрыми частицами – радиационные дефекты; при отклонении химического состава от стехиометрии – стехиометрические дефекты.
Первичным продуктом при любом механизме образования точечных дефектов является возникновение пары Френкеля (рис. 13, б).
| |
Подобные дефекты возникают только в кристаллах, содержащих большие межатомные промежутки. Плотность кристаллов остается постоянной, поскольку объем не изменяется.
Кроме этого, над поверхностью твердого тела, как и над жидкостью, всегда существует пар, состоящий из атомов данного вещества. Атомы отрываются от поверхностных слоев кристалла. На месте отрыва атома образуются катионная и анионная вакансия (рис.13, а) или одиночный точечный дефект – дефект по Шоттки.Он образуется в плотно упакованных кристаллах, в которых нет возможности для образования междоузельных атомов. Впоследствии вакансия, образовавшаяся в результате перехода атома на поверхность, может мигрировать в объем кристалла. Она может распространяться хаотически либо образовывать связанные пары. Выход на поверхность одного иона мало вероятен, из-за возникновения при этом нескомпенсированного заряда в объеме кристалла.
Дефекты по Шоттки уменьшают плотность кристалла вследствие увеличения его объема при постоянной массе. Наиболее характерны для структур типа NaCl. Образование дефектов по Шоттки является термодинамически невыгодным.
Точечные радиационные дефекты возникают при облучении кристаллов быстрыми частицами (p, n, ē), а также осколками деления ядер или ускоренными ионами. Радиационные дефекты термодинамически невыгодны и нестабильны. После прекращения облучения состояние не является стационарным.
Прохождение заряженных частиц через кристалл сопровождается их упругими столкновениями с атомами кристалла. Если энергия, переданная атому в результате столкновения, превышает некоторое значение, он выбивается из узла кристаллической решетки, оставляет вакансию и начинает движение через кристалл, т. е. этот первый атом сталкивается и выбивает второй атом, тот следующий, в результате чего возникает т. н. каскад атомных смещений (рис.14).
| |
| Рис. 14. Образование радиационных дефектов |
Линейные дефектыобразуются в процессе роста или пластической деформации кристалла.
Образование дислокаций в процессе роста кристаллов происходит в тех случаях, когда растущие навстречу блоки и зерна повернуты друг относительно друга. При срастании таких блоков образуются избыточные атомные плоскости – дислокации.
В процессе пластической деформации происходит не одновременный сдвиг атомов данной плоскости, а последовательное перемещение связей между атомами, лежащими по обе стороны линии скольжения. Такое перераспределение связей предопределяет движение дислокаций от одной группы атомов к другой. Количество дислокаций в твердых кристаллических телах очень велико. Число дислокаций, пересекающих 1см2 площади внутри кристалла, может достигать 104 –106 и более.
Наличие дислокаций значительно снижает прочность кристаллов на несколько порядков. Дислокации влияют на электрические, оптические, магнитные и другие свойства материалов.
| |
О существовании подобных явлений в кристаллических материалах впервые предположили Дж. Тейлор и Е. Орован, установившие наличие таких смещений в строго симметричных кристаллических решетках. Дж. Тейлор предположил существование линейных смещений частей кристаллов, которые сдвигаются друг относительно друга под действием внешней силы и представляют собой ступенчатый сдвиг.
На рис.16 изображена дислокация ОО1, возникшая в результате сдвига частей кристалла на одно межатомное расстояние и показано расположение атомов в плоскости перпендикулярной линии дислокации.
| |
| Рис. 16. Механизм образования краевой дислокации |
Образование краевой дислокации можно представить, если вставить дополнительную плоскость MNO1O между плоскостями идеального кристалла. Усилие, необходимое для перемещения дислокации, невелико и если бы не было дислокаций, то материалы были бы более твердыми и вместо пластической деформации ломались (как большинство ТНиСМ).
| |
| Рис. 17. Механизм образования винтовой дислокации |
Дж. Бюргерсом было введено представление еще о двух типах дислокаций. Первый состоит в образовании плоскостей решетки, которые перемещаются по кристаллу, вращаясь вокруг некоторой оси. В кристалле происходит сдвиг, как показано на рис. 17.
Линия дислокации ОО1, отделяющая область, где сдвиг произошел от области, в которой сдвига не было, в этом случае не перпендикулярна, а параллельна вектору сдвига. Кристалл можно представить как состоящий из одной атомной плоскости, «закрученной» вокруг оси ОО1, как винтовая лестница. Такая дислокация получила название винтовой дислокации.
Второй тип дислокации Бюргерса состоит в том, что зона сдвига ограничена внутри кристалла не прямой линией, а произвольной кривой. Линия ОО1 представляет собой криволинейную дислокацию, которая в точке О параллельна вектору сдвига и имеет винтовой характер, а точка О1 – линия дислокации перпендикулярна вектору сдвига и имеет краевую ориентацию. Такие дислокации получили название смешанных дислокаций (рис.18).
| Рис. 18. Механизм образования криволинейной дислокации |
| |
Одной из важнейших характеристик дислокации является вектор смещения – вектор Бюргерса ( 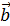 ), который определяется при построении замкнутого контура (контура Бюргерса) в идеальном или реальном кристалле.
), который определяется при построении замкнутого контура (контура Бюргерса) в идеальном или реальном кристалле.
При этом любую область реального кристалла, где можно установить полное совпадение с идеальной, называют областью хорошего кристалла, а участки, где такое совпадение установить нельзя, называют областью плохого кристалла.
Контур Бюргерса строится в идеальном кристалле так, что переход от атома к атому происходит последовательно, не покидая область хорошего кристалла.
Если в реальном кристалле контур проведен вокруг дислокации (рис. 19, а), то соответствующий контур в идеальном кристалле оказывается разомкнутым (рис. 19, б между точками А и В). Чтобы замкнуть этот контур, его необходимо заполнить вектором 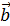 – вектором Бюргерса.
– вектором Бюргерса.
| Рис. 19. Контур Бюргерса краевой дислокации в реальном (а) и исходном идеальном кристалле (б) |
| |
Направление вектора Бюргерса определяется двумя правилами:
– если положительное направление дислокации выбрано произвольно, то обход контура Бюргерса определяется по правилу правого винта;
– вектор Бюргерса всегда направлен от конца точки В к началу точки А.
Для краевой дислокации вектор Бюргерса направлен перпендикулярно линии дислокации и есть ни что иное, как вектор сдвига.
Вектор Бюргерса винтовой дислокации параллелен линии дислокации. Контур Бюргерса может быть смещен вдоль дислокации, растянут или несколько сжат в направлении, перпендикулярном линии дислокации. Дислокация вдоль всей своей длины имеет постоянный вектор Бюргерса и значит не может нигде оборваться внутри кристалла. Обрыв дислокации может произойти только на поверхности кристалла, на межкристалльной границе или на другой дислокации.
Дислокация является таким дефектом, который может легко двигаться через кристалл. Существует два способа движения дислокаций: путем скольжения и путем переползания.
Передвижение дислокаций путем скольжения (рис.20, а) осуществляется на одно межатомное расстояние за счет небольшой перестройки атомов вблизи линии дислокации. Скольжение не сопровождается переносом массы и осуществляется под действием небольших касательных напряжений (t).
| Рис. 20. Способы движения дислокаций путем скольжения (а) и путем переползания (б) |
| |
Поверхностные дефектыпредставляют собой области кристалла с сильно нарушенным периодическим расположением атомов, имеющие форму некоторой поверхности, толщина которой в направлении нормали к поверхности составляет 1-2 межплоскостных расстояния. К поверхностным дефектам относят: дефекты упаковки, границы зерен и двойников, границы доменов, ряды дислокаций и сетки дислокаций.
Дефекты упаковки можно рассмотреть на примере гранецентрированной решетки (рис.21).
Предположим, что атомы А, В, С лежат в плоскостях с индексами {111}. Структуру такого атома можно представить как серию плотно упакованных плоскостей, уложенных друг на друга в последовательности АСВ…АСВ...АСВ. Если происходит сдвиг верхнего слоя на расстояние АА, то атомы вышележащей плоскости попадают из лунки А в лунку А и структура после смещения восстанавливается. Образование дефектов упаковки происходит в том случае, когда нарушается порядок чередования плоскостей, который может осуществляться двумя способами:
| |
| Рис. 21. Гранецентрированная кристаллическая решетка |
– если между соседними слоями находится лишний слой в результате диффузии междоузельных атомов, то при введении слоя В получаем упаковку АСВВ…АСВ…АСВ. Такой вид дефекта получил название дефекта внедрения.
Границы зерен – границы раздела разориентированных участков в поле кристалла.
Границы зерен представляют собой поверхность между двумя поликристаллами различной ориентации, примыкающими друг к другу таким образом, что отсутствует нарушение сплошности вещества.
| |
Если угол θ >5º, то граница считается большеугловой и характеризует структуру из периодически повторяющихся элементов, которая присуща жидким или аморфным веществам.
Если угол θ <5º, то граница малоугловая и характеризует структуру с сеткой краевых дислокаций.
Границы зерен оказывают влияние на электропроводность, поглощение звука, оптические, тепловые свойства и др. Наличие границ зерен приводит к тому, что в поликристаллических веществах наблюдается высокий коэффициент диффузии примесей. Наличие дефектов упаковки приводит к нарушению сплошности материалов и оказывает влияние на механические свойства.
Объемные дефекты представляют собой нарушения сплошности материала ввиду скопления вакансий, включения посторонней фазы, пузырьков газов, скопления примесей на дислокациях и в зонах роста кристаллов.
Нарушение сплошности – это полость в кристалле, наименьший размер которой превышает радиус действия межатомных сил.
В ненагруженном кристалле различают 2 типа нарушения сплошности: поры и трещины.
Трещины обладают собственным полем напряжений, а кристалл вокруг поры свободен от напряжений.
В отличие от трещины пора возникает в результате объединения дефектов, не имеющих дальнодействующих полей напряжений.
Возможные механизмы зарождения и роста трещин представлены на рис.23.
| |
| |
в) г)
Дата добавления: 2014-08-09; просмотров: 828; Нарушение авторских прав 
Мы поможем в написании ваших работ! |