
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ
16.1. Металлами являются большинство элементов периодической системы Д.И. Менделеева.
Физические, механические и химические (восстановительные) свойства металлов в основном обусловлены содержанием в них «свободных» электронов. В твердом состоянии металлы отличаются от остальных веществ высокой теплопроводностью и электрической проводимостью, полной непрозрачностью, высокой отражательной способностью по отношению к видимому свету (металлическим блеском).
Металлы обладают специфическими механическими свойствами: куются, прокатываются, вытягиваются, некоторые имеют большую прочность при натяжении или сжатии.
При взаимодействии металлов с атомами неметаллов химическая активность металлов определяется его энергией ионизации. Мерой восстановительной способности металла в реакциях с растворами электролитов является электродный потенциал металла.
Металлы проявляют сильные восстановительные свойства, то есть, способны отдавать электроны, переходя в положительно заряженные ионы. По степени химической активности металлы располагают в ряд напряжений.
CuSO4 + Fe ® FeSO4 + Cu
красный цвет
Сu2+ + Fe ® Fe2+ + Cu
1) Ca + H2 ® Ca2+ + H–12 гидриды
2) W + C ® WC карбиды
3) 2Fe + O2 ® 2FeO оксиды
4) Fe + S ® FeS сульфид
5) Fe + Cl2 ® FeCl2 хлорид
6) 2Na + 2H2O ® 2NaOH + H2 с водой
Ca + 2H2O ® Ca(OH)2 + H2
7) Mg + 2HCl ® MgCl2 + H2 с кислотой
3H2SO4 + 2Al ® Al2(SO4)3 + 3H2
 Cu SO2
Cu SO2
H2S+6O4 Zn S0 S+6 восстанавливается
Ca H2S–2
 Fe, Cl пассивируют
Fe, Cl пассивируют
Тяжелые металлы NO2
HNO3 Щелочные N2O
щелоч. щ – з. Sn, Fe NH3 (NH4NO3)

HNO3 тяжелые металлы NO
разб.
16.2. Химические свойства металлов.
1) Простые вещества:
Li (K, Na, Ba)+O2®Li2O (K2O, Na2O, CaO, BaO) при комнатной t0
2Cu + O2 ® 2CuO
2Fe + 3Cl2 ® FeCl3
Zn + S ® ZnS
3Mg + N2 ® Mg3N2
4Al + 3C ® Al4C3
3Ca + 2P ® Ca3P2
Ca + H2 ® CaH2
Li, K, Ba, Ca, Na окисляются при обычных условиях;
Cu, Hg при нагревании;
Ag, Pt, Au не окисляются.
2) Сложные вещества:
(H2O, кислоты, соли)
2Na + 2H2O ® 2NaOH + H2 (металлы главной подгруппы 1 гр. и Co, Sr, Ba)
Zn + H2SO4(р) ® ZnSO4 + H2
Cu + H2SO4(k) ®
Mg + 2HCl ® MgCl2 + H2
Li, K, Ba, Ca, Na, Sr – реагируют с Н2О при обычных условиях;
Mg, Al, Mn, Zn, Fe, Ni – реагируют с парами воды;
Su, Pb, Cu, Hg, Ag – не реагируют с водой при нагревании.
3) Cu + 2H2SO4(k) ® CuSO2 + SO2 + H2O
3Zn + 4H2SO4(k) ® 3ZnSO4 + S0¯ + 4H2O
4Ba + 5H2SO4(k) ® 4BaSO4 + H2S + 4H2O
Cu + 4HNO3(k) ® Cu(NO3)2 + 2NO2 + 2H2O
Fe + 4HNO3(p) ® Fe(NO3)3 + NO + 2H2O
4Zn + 10HNO3(k) ® 4Zn(NO3)2 + N2O + 5H2O
5Mg + 12HNO3(p) ® 5Mg(NO3)2 + N2 + 6H2O
4Ca + 10HNO3(p) ® 4Ca(NO3)2 + NH4NO3 + 3H2O
Металлы от Li до Pb реагируют с разбавленными кислотами;
Cu, Hg, Ag, Pt, Au – не реагируют с разбавленными кислотами (кроме HNO3);
Растворы солей.
Zn + CuCl2 ® ZnCl2 + Cu (более активный металл вытесняет из раствора соли менее активный металл).
Ba + 2H2O ® Ba(OH)2 + H2
Ba(OH)2 + CuCl2 ® BaCl2 + Cu(OH)2¯
Ba + CuCl2 + 2H2O ® Cu(OH)2¯ + H2 + BaCl2
Так реагируют с водными растворами солей очень активные металлы (Li, Na, K, Rb, Cs, Ca, Sr, Ba.)
Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, (H2), Cu, Ag, Hg, Pb.
 Восстановительная способность простых веществ понижается.
Восстановительная способность простых веществ понижается.
 Li+,K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Cr3+,Fe2+,Pb2+,(2H+),Cu2+,Ag+,Hg2+,Pb2+
Li+,K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Cr3+,Fe2+,Pb2+,(2H+),Cu2+,Ag+,Hg2+,Pb2+
Окислительная способность гидратированных ионов усиливается
16.3.Металлы II группы главной подгруппы – бериллий, магний, кальций, стронций, барий и радий. Их (кроме бериллия и магния) называют щелочно – земельными металлами
Основные сведения об элементах кальция и магния.
| Символ элемента | Mg | Ca |
| Латинское название | Magnesium | Calcium |
| Русское название | магний | Кальций |
| Год открытия | ||
| Авторы открытия | Г. Дэви | Г. Дэви |
| Содержание в земной коре, массовая доля,% | 2,1 | 3,6 |
| Основные природные соединения | 2MgO*SiO3 (оливин) MgCO3 (магнезит) MgCO3*CaCO3 (доламит) MgCl2*KCl6*6H2O (карналлит) | CaCO3 (кальцит) CaO*Al2O3*2SiO2 (апортит) CaSO4*2H2O (гипс) CaF2 (флюорит) Ca3(PO4)2 (фосфорит) Ca5(PO4)3X (Х=F,Q,OH) (апатит) |
Кальций. Основные свойства, получение.
| Физические свойства | Химические свойства | Способы получения |
| Серебристо- белый металл ρ=1,550 кг/м3 Тпл=839 0С Удельное электро-сопротивление 0,038 мкОм*м. Соединения Са окрашивают пламя в оранжево – красный цвет | Взаимодействие с простыми веществами (неметаллами-O2, N2, P, C, Cl2, H2) Ca+Cl2→CaCl2 | Электролиз расплава СаСl2 с добавлением CaF2 для снижения температуры плавления CaCl2 Метод электротермия: 14CaO+6Al→5CaO* *3Al2O3+9Ca |
Соединения кальция. Химические свойства, получение.
| Соединения | Химические свойства | Способы получения |
| СаО – оксид кальция (жженая известь) | CaO+H2O→Ca(OH)2 CaO+SO3→CaSO4 CaO+2HCl→CaCl2+H2O CaO+3C→CaC2+CO | Прокаливанием известняка CaCO3→ →CaO+CO2↑ |
| Ca(OH)2- гидроксид кальция (гашеная известь) | Обладают свойствами щелочи Ca(OH)2+H2SO4→CaSO+2H2O Ca(OH)2+CO2→CaCO3↓+H2O Ca(OH)2+SiO2→CaSiO3↓+H2O 3Ca(OH)3+2K3PO4→Ca3(PO4)2+6KOH | Взаимодействием CaO с водой CaO+H2O→Ca(OH)2 |
| Ca3N2 – нитрид кальция | Ca3N2+6H2O→3Ca(OH)2+2NH3 | 3Ca+N2→Ca3N2 |
| Ca3P2 – фосфид кальция | Ca3P2+6H2O→3Ca(OH)2+2PH3 | 3Ca+2P→Ca3P2 |
| CaC2 – карбид кальция | CaС2+2H2O→Ca(OH)2+С2H2↑ | Ca+2C→CaC2 |
| CaH2 – гидрид кальция | CaН2+2H2O→Ca(OH)2+2H2↑ | Ca+H2→CaH2 |
| CaCl2 Ca(NO3)2 CaSO4, CaCO3, CaSiO3 | Проявляют все химические свойства солей CaCO3→CaO+CO2↑ | Взаимодействием CaO или Ca(OH)2 с соответствующими кислотами |
| CaSO4*2H2O гипс | 2[CaSO4*2H2O] → →2CaSO4*H2O+3H2O↑ | CaSO4+2H2O→CaSO4*2H2O |
| 2CaSO4*H2O аллебастр | Нагреванием гипса до 150-1800С |
16.4. Жесткость – один из технологических показателей, принятых для характеристики состава и качества природных вод.
Жесткость можно измерить ммоль/дм3 или ммоль/л.
Общая жесткость воды представляет сумму временной и постоянной жесткости.
Сумма концентраций ионов Са2+ и Mg2+ является количественной мерой жесткости воды: Жн2о= С Cа2+ + С Mg2+.
Концентрация ионов Са2+ и Mg2+ в воде эквивалентная содержанию иона HCO3-, определяет карбонатную (временную) жесткость воды, а концентрация Са2+ и Mg2+, эквивалентная всем другим анионам (SO42-, Cl-, и т.д.) – некарбонатную (Постоянную)
Использование природной воды в технике требует ее предварительной очистки, и умягчения (снижения жесткости до определенной нормы).
Способы устранения жесткости воды.
| Вид жесткости | Соли, обуславливаю-щие жесткость воды | Способы устранения жесткости (умягчения) воды. |
| КАРБОНАТНАЯ (временная) | Ca(HCO3)2 Mg(HCO3)2 Fe(HCO3)2 | Нагреванием до 70-800С (кипячением) Ca(HCO3)2→CaCO3↓+ +CO2+H2O Mg(HCO3)2→MgCO3+ +CO2↑+H2O Ca(HCO3)2+Ca(OH)2→ →2CaCO3↓+2H2O |
| НЕКАРБОНАТНАЯ (постоянная) | CaSO4 , MgSO4 , CaCl2 , MgCl2 | 1. Химическими методами: CaSO4+Na2CO3→ CaCO3↓+Na2SO4 3CaSO4+2Na2PO3→ Ca3(PO4)2↓+3Na2SO4 2. Использование ионноотменных смол (катионов, анионов) то есть Са2+ и Mg2+ обмени-ваются на катио-ны Na+ содержащиеся в применяемом катионе |
При контроле качества воды определяют ее жесткость. Определение карбонатной жесткости воды проводят методом нейтрализации.
В основе этого метода лежит титрование воды в присутствии метилового оранжевого раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую. Для определения общей жесткости применяют метод комплексонометрии.
В основе этого метода лежит титрование воды в присутствии буферного раствора (рН=10.0) и индикатора хромогена черного раствором комплексона III (трилона Б) до перехода винно-красной окраски в синюю.
Комплексон III – двузамещенная натриевая соль этилендиаминтетрауксусной кислоты
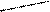
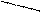 NaOOCH2C CH2COOH
NaOOCH2C CH2COOH




 N CH2 CH2 N
N CH2 CH2 N
HOOCH2C CH2COONa
При титровании жесткой воды раствором комплексона III образуется внутрикомплексное соединение.
 | |||||
 |  | ||||

 NaOOCH2C CH2COO
NaOOCH2C CH2COO

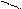
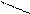


 N CH2 CH2 N
N CH2 CH2 N



 OOCH2C CH2COONa
OOCH2C CH2COONa
 | |||||
 |  |
 Са2+
Са2+
При этом связываются ионы Са2+ и Mg2+.
16.5. Коррозия — это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
анодный — окисление металла

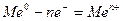
и катодный — восстановление ионов водорода
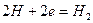
или молекул кислорода, растворенного в воде,
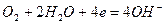
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии — коррозии во влажном воздухе при комнатной температуре — деполяризатором является кислород.
Коррозия металлов - это процесс их химического разрушения под действием окружающей среды.
Виды коррозии металлов.
| Вид коррозии | Описание коррозийного процесса |
| Химическая (разрушение металла при взаимодействии его с сухими газами или жидкостями, не проводящими электрического тока) | Процесс идет с разрушающим металлы веществом (кислород воздуха, водой, H2S, SO2, и др.) Пример: Fe+H2S=FeS+H2 Fe+SO2+H2O=FeSO3+H2 |
| Электрохимическая (разрушение металла в среде электролита) | Электрохимическая коррозия железа, где железо находится в контакте с медью. В природной воде присутствуют ионы H+, OH-, HCO3-, Cl- и др. Электролиты от более активного металла железа, переходят в менее активный - медь, то есть медь становится катодом, а железо- анодом У поверхности железа (анод) образуется катионы низкой степени окисления (+1): Fe2++OH-=(FeOH)+ затем (FeOH)++Fe(OH)2+HCO3=(FeOH)2CO3+H2 Под действием Н2О и О2 идет реакция 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 Если к катоду подходит кислород, то образуется вода 4H0+O2=2H2O Таким образом железо, как более активный металл разрушается, так как образуется слой рыхлой ржавчины, не защищающий железо от дальнейшей коррозии |
16.6. Типы защиты металлов от коррозии.
| Метод | Схема реализации | Область применения |
| Катодная защита | На некотором расстоянии от трубопровода в землю зарывается идущий параллельно ему металлический анод, который образует с трубопроводом гальваническую пару. | Защита подземных трубопроводов и металлических емкостей. |
| Металлургический | Введение в состав стали в процессе ее плавки легирующих элементов: Cr, N, Mn, Si, W, V | В машиностроении для создания коррозийно - стойких сталей и сплавов |
| Нанесение металлических, оксидных и органических покрытий | Анодное покрытие (цинкование). Катодное покрытие (лужение - покрытие оловом), хромирование и др. Оксидирование (погружение железа в щелочь с окислителем) Анодирование в гальванических ваннах. Покраска и лакировка. | В общем, энергитическом и химическом машино-строении, а так же в автомобилестроении, авиа - и кораблестроении. |
16.7. Примеры решения задач.
Пример.1. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах. Составьте электронные уравнения анодного и катодного порцессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный потенциал (—0,763 В), чем кадмий (—0.403 В), поэтому он является анодом, а кадмий катодом.
анодный процесс: 
катодный процесс: в кислой среде 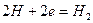
в нейтральной среде: 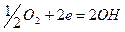

Так как ионы 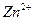 с гидроксильной группой образует нерастворимый гидроксид, то продуктом коррозии будет
с гидроксильной группой образует нерастворимый гидроксид, то продуктом коррозии будет  .
.
16.8. Задания для контрольной работы .
301. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процесса.
302. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опушенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
303. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
304. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой па последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.
305. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
306. Железное изделие покрыли никелем. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и втором случаях
307. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний—никель. Какие продукты коррозии образуются в первом и во втором случаях?
308.В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее?
Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
309.Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
310. Какое покрытие металла называется анодным и какое — катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и кислой среде.
311. Железное изделие покрыли кадмием. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
312. Железное изделие покрыли свинцом. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
313. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
314. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Каков состав продуктов коррозии?
315 Какой метод умягчения воды называют термическим ? Какие химические реакции протекают при умягчении воды этим методом ?
316. Как определить общую жесткость воды ?
317 На титрование 200 мл H2O израсходовано по 8 мл 0.1Н раствора комплексона III. Вычислите общую жесткость воды. (ответ 4 ммоль/л).
318 Как находят карбонатную жесткость. Напишите уравнения реакций.
319 Вычислите общую жесткость воды, если на титрование 200 мл Н2О израсходовано 7.6 мл 0.05Н комплексона III.
320 Вычислите карбонатную жесткость воды, если на титрование 100 мл Н2О израсходовано 1.5 мл 0.1Н раствора HCl (ответ 1.5 ммоль/л).
| <== предыдущая страница | | | следующая страница ==> |
| | | ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ. ПОЛИМЕРЫ |
Дата добавления: 2014-09-08; просмотров: 511; Нарушение авторских прав

Мы поможем в написании ваших работ!