
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
БИОТЕХНОЛОГИЯ КАК НАУКА И ОТРАСЛЬ ПРОИЗВОДСТВА
I. ПОНЯТИЕ О БИОТЕХНОЛОГИИ, ЕЁ ЗАДАЧИ
Под биотехнологией понимают отрасль биологической науки, которая включает в себя технологические процессы, направленные на использование клеточных культур, метаболизм и биосинтетические возможности которых обеспечивают выработку ценных продуктов.
Таким образом, биотехнология создаёт возможность получения с помощью легкодоступных и возобновляемых ресурсов тех веществ и соединений, которые важны для жизни и благосостояния людей.
Термин «Биотехнология» был предложен в 1917 г. К. Эреки для обозначения всех видов работ, в которых продукты получают с помощью живых организмов.
Современное понятие биотехнологии:
Наука и отрасль производства о генно-инженерных и клеточных методах и технологиях создания и использования генетически модифицированных растений, животных и микроорганизмов в целях интенсификации производства и получения новых видов продуктов различного назначения.
Основной задачей биотехнологии является разработка процессов, в которых микроорганизмы культур растительных и животных клеток, выделенные из них ферменты, мембраны и клеточные органеллы в свободном или иммобилизованном состоянии используются для получения нужных для человека веществ. Кроме того биотехнология решает задачи, стоящие перед наукой о способах улучшения продуцентов и задачи, стоящие перед производством об интенсификации технологических процессов.
II. ОСНОВЫНЕ ЭТАПЫ СТАНОВЛЕНИЯ БИОТЕХНОЛОГИИ
1. Допастеровский период
Использование процессов хлебопечения, виноделия, сыроделия без знания объекта, осуществляющих их.
2. Послепастеровская эра (1858-1940)
Связан с освоением способов культивирования микроорганизмов, как объектов биотехнологических процессов.
3. Эра антибиотиков (1940-1960)
4. Период управляемого синтеза (1960-1975)
Связан, в первую очередь, с химическим синтезом фрагментов ДНК, с разработкой модели оперонной регуляции экспрессии генов в организме бактерий.
1972 год – рождение генетической инженерии
5. Современная биотехнология (с 1975 года).
III. СОВРЕМЕННАЯ БИОТЕХНОЛОГИЯ: ЕЁ ОСНОВНЫЕ ДОСТИЖЕНИЯ И ОБЛАСТИ ПРИМЕНЕНИЯ
Современная биотехнология, базируясь на методах клеточной и генной инженерии, путём конструирования нужных генов позволяет управлять наследственностью и жизнедеятельностью микроорганизмов, растений и животных и создавать организмы с новыми полезными свойствами, ранее не наблюдавшимися в природе; а именно позволяет создавать организмы с повышенной устойчивостью к стрессовым факторам среды, высокой продуктивностью и качеством продукции, решать задачи по оздоровлению экологической обстановки в природе и во всех отраслях промышленности.
Основные достижения биотехнологии:
1. 1975 год – впервые, путём гибридизации соматических клеток, получены гибридомы, секретирующие моноклональные антитела.
2. 1978 год – впервые продемонстрирована экспрессия генов гормоном мозга человека – соматотропина и поджелудочной железы – инсулина в бактериальных клетках; инсулин стал первым созданным генно-инженерными методами продуктом, который поступил в продажу и используется людьми, страдающими сахарным диабетом.
3. 1982 год – разрешена к использованию первая вакцина для животных, полученная по технологии рекомбинантных ДНК.
4. 1983 год – показана впервые экспрессия гена растений в растениях других видов.
5. 1986 год – прошло полевое испытание в США и Франции первое трансгенное растение – устойчивый к гербициду табак.
6. 1997 год – продемонстрирована возможность получения потомства млекопитающих путём оплодотворения яйцеклеток, лишённых ядер, ядрами соматических клеток; этот способ получил название «клонирование» и первым клонированным млекопитающим была овца «Долли».
Сегодня успешно развиваются такие отрасли биотехнологии, как:
- биотехнология пищевых продуктов
- биотехнология улучшения продуктивности сельского хозяйства
- биотехнология препаратов для сельского хозяйства
- биотехнология лекарственных препаратов и средств диагностики
- биотехнология препаратов и продуктов для промышленного использования
- биотехнология утилизации отходов и, тем самым, уменьшение загрязнение окружающей среды.
IV. ОСНОВНЫЕ НАПРАВЛЕНИЯ РАЗВИТИЯ БИОТЕХНОЛОГИЧЕСКИХ ПРОИЗВОДСТВ В РБ
Согласно государственной программе «Инновационные биотехнологии» (2010-2015) одним из основным факторов экономического развития РБ является внедрение в практику наукоёмких и эффективных производств и технологий.
По уровню биотехнологических исследований и разработок, их внедрения в промышленные производства, РБ отстаёт от развитых зарубежных стран: недостаточные объёмы производства средств защиты растений, биоудобрений, консервантов, кормов.
Неблагоприятная ситуация сложилась в области микробиологической промышленности из-за устаревшего оборудования. В связи с этим планируется:
1. Создание 9 новых организаций по производству препаратов из плазмы крови, бактериальных концентратов для молочной промышленности, кормовых аминокислот, кормовых добавок и др.
2. Создание новых организационных структур биотехнологического профиля для репродукции сельскохозяйственных животных, их сертификации и ДНК-маркирования.
3. Модернизация ряда республиканских унитарных предприятий
4. Разработка новых методов биопрепаратов, тест-систем, биотоплива, вакцин и др.
Трёхкомпонентный состав современной биотехнологии
1. Генетическая инженерия
2. Промышленная биотехнология
3. Клеточная инженерия
ОБЪЕКТЫ БИОТЕХНОЛОГИИ
I. МИКРООРГАНИЗМЫ – ОСНОВЫНЕ ОБЪЕКТЫ БИОТЕХНОЛОГИИ; ПРИНЦИПЫ ПОДБОРА БИОТЕХНОЛОГИЧЕСКИХ ОБЪЕКТОВ
К биотехнологическим объектам относятся биоорганизмы, а также клетки растений и животных, субклеточные компоненты, а также и интактные растения и животные.
Некоторые примеры, доказывающие роль микроорганизмов, как основных объектов биотехнологии:
1. Одноклеточные организмы характеризуются более высокими скоростями роста и синтетических процессов про сравнению с высшими многоклеточными организмами. Следует отметить, что некоторые микроорганизмы растут крайне медленно, однако представляют известный интерес, поскольку способны продуцировать различные ценные вещества.
2. Особое внимание как объекты представляют фотосинтезирующие микроорганизмы, использующие в своей жизнедеятельности энергию солнечного света. Часть из них (цианобактерии, фотосинтезирующие протисты) в качестве источника углерода используют CO2, тем самым утилизируя его. Некоторые цианобактерии, кроме того, могут фиксировать атмосферный азот, и являются крайне неприхотливыми к питательным веществам. Фотосинтезирующие микроорганизмы перспективны как продуценты водорода, белка и ряда органических соединений.
3. Определённое внимание уделяется термофильным микроорганизмам, растущим при температурах от 60 до 80 градусов Цельсия; это их свойство является практически непреодолимым препятствием для развития посторонней микрофлоры при нестерильных условиях выращивания. Среди термофилов известны продуценты спиртов, аминокислот, ферментов и водорода. Кроме того, скорость их роста и метаболическая активность в 1,5-2 раза выше, чем у мезофиллов. Ферменты, синтезируемые термофилами, устойчивы к нагреванию, некоторым окислителям и другим неблагоприятным факторам среды. В тоже время термофилы мало активны при обычных температурах. В биотехнологическом процессе используются микроорганизмы, относящиеся к группе GRAS, которые считаются безопасными; в их числе можно назвать E. coli, Bacillus subtilus, род Aeobacterium, род Rizobium, Thermus aquaticus, Saccharmices cervisia, Penicilium, Aspergilium. GRAS-микроорганизмы считаются не патогенными, не токсичными, поэтому при разработке нового биотехнологического процесса используется как базовые объекты. Современная микробиологическая промышленность использует 1000 штаммов микроорганизмов, которые первоначально были выделены из природных источников на основании их полезных свойств, а затем улучшенные с помощью различных методов. В связи с расширением производства и ассортимента выпускаемой продукции микробиологической промышленностью вовлекаются новые представители микроорганизмов. Следует отметить, что степень их изученности отстаёт от знаний о базовых объектах. Причина этого – большая трудность и высокая стоимость проводимых исследований. Классический подход заключается в выделении нужного микроорганизма из природных популяций и осуществлении посева на селективную питательную среду. Культивирование на селективной среде позволяет получить т.н. накопительную культуру. Следующим этапом является выделение чистой культуры с дальнейшим изучением изолированного микроорганизма, а в случае необходимости – ориентировочным определением его продуктивной способности. Существует и другой путь подбора микроорганизмов – выбор нужного вида из имеющихся коллекций GRAS-организмов. Главным критерием при выборе биотехнологического объекта является его способность синтезировать целевой продукт. Однако помимо этого в технологию самого процесса могут закладываться дополнительные требования. В целом микроорганизм как объект должен обладать высокой скоростью роста, утилизировать необходимые для жизнедеятельности дешёвые субстраты и быть резистентным к посторонней микрофлоре.
II. ГЕНЕТИЧЕСКИЕ СПОСОБЫ УЛУЧШЕНИЯ ПРОДУЦЕНТОВ; ВЫДЕЛЕНИЕ И СЕЛЕКЦИЯ МИКРООРГАНИЗМОВ
Неотъемлемым компонентом в процессе создания наиболее ценных и активных продуцентов является их селекция. Главным путём селекции является сознательное конструирование геномов на каждом этапе отбора нужного продуцента. Это не могло быть реализовано при отсутствии эффективных методов улучшения продуцентов. Основными методами являются:
1. Гибридизация, подразумевающая вовлечение продуцентов в схему скрещиваний по изменению их генетической составляющей.
2. Селективный отбор при культивировании микроорганизмов на питательных средах, содержащих селективный фактор. При этом используется метод ступенчатой клетчатой селекции, т.е. на каждом этапе отбора из популяций микроорганизмов отбираются спонтанные мутанты, из которых на следующем этапе отбора отбирают новые, более эффективные штаммы и т.д.
3. Метод индуцированного мутагенеза: в качестве мутагенных факторов используют ультрафиолетовое излучение, рентгеновское и гамма-излучение, химические вещества. Однако этот метод также имеет недостатки, главный из которых – трудоёмкость и отсутствие сведений о характере изменений, происходящих внутри микроорганизмов. Вышеназванные генетические способы улучшения продуцентов направлены на отбор микроорганизмов по конечному результату эксперимента. В качестве современных методов можно назвать методы генной инженерии.
III. ПРЕДМЕТ, ЗАДАЧИ И МЕТОДЫ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
Генетическая инженерия – научное направление, связанное с целенаправленным созданием в условиях in vitro новых комбинаций генетического материала с последующим его введением в живой организм.
Фундаментальной основой генетической инженерии является молекулярная биология и молекулярная генетика. Ряд важнейших открытий в этих областях способствовал возникновению генетической инженерии.
Кроме научных достижений становление генетической инженерии способствовали разработка и постоянное совершенствование приборов для исследования нуклеиновых кислот, аминокислот, синтеза биополимеров, устройства для хроматографии, сканирование гелей и др.
Таким образом к началу 70-х годов появилась возможность для перехода от анализа генов к их синтезу от изучения генетической природы организмов к их переделке.
1972 год – в лаборатории американского учёного П. Берга удалось сшить между собой 2 фрагмента ДНК: бактериофага λ и вируса SV40 обезьян.
7.03.2014; Лекция 3/15
Задачи генетической инженерии:
1. Выделение, конструирование и клонирование новых рекомбинантных генов и молекул ДНК
2. Введение в геном реципиентной клетки одного или нескольких обычно чужеродных генов, либо создание в геноме новых типов регуляторных связей
3. Создание банка генов
Для решения этих задач в генетической инженерии разработаны следующие методы:
1. Методы переноса генов в различные организмы
2. Методы рекомбинации и конструирования очищенных из клеток генов
3. Методы переноса генов в клетки различных организмов
В настоящее время генетическая инженерия подразделяется на 2 направления: генная и геномная инженерии.
Поскольку геномная инженерия направлена на конструирование геномов, находится на стадии накопления экспериментального материала, поэтому генную инженерию называют генетической.
IV. ИНСТРУМЕНТЫ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕНРИИ
К инструментам относят различные ферментные системы, которые лишены видовой специфичности, поэтому их можно использовать для работы с нуклеиновыми кислотами организмов различных таксономических групп и, тем самым, преодолевать барьеры межвидовой несовместимости.
Ферменты делятся на 3 группы:
1. Ферменты, с помощью которых происходит разделение молекулы ДНК на фрагменты – рестриктазы.
2. Ферменты, необходимые для восстановления ковалентных связей между нуклеотидами фрагментов с образованием целостной структуры – лигазы.
3. Ферменты, необходимые для наработки молекул ДНК на матрице ДНК – полимеразы.
3.1. Обратные транскриптазы – разновидность полимераз, осуществляющие наработку фрагментов ДНК на матрице и-РНК.
РЕСТРИКТАЗЫ: ИХ ОСНОВНЫЕ ХАРАКТЕРИСТИКИ И МЕХАНИЗМЫ ФУНКЦИОНИРОВАНИЯ
Впервые были выделены в 1968 году Арбером из клеток бактерий, в которых они являются эндонуклеазами и выполняют так называемую функцию внутриклеточной иммунной защиты. В связи с этим рестриктазы являются уникальными, поскольку могут отличать ДНК бактериальной клетки, в которой находятся, от чужеродной ДНК, проникающей в эту клетку. В связи с этим рестриктазы были названы, исходя из латинского названия бактерии, из которой они были выделены.
Escherichia coli – EcoR1 (Eco – первая буква рода и первые две буквы вида, R – рестриктаза только для E. coli, 1 – номер);
Thermus aquaticus – TaqI (I – латинская цифра).
Рестриктазы классифицируются на 3 типа, однако в генетической инженерии используются рестриктазы только 2-го типа, поскольку только у них сайт узнавания совпадает с сайтом рестрикции.
Сайт рестрикции – место/участок молекулы ДНК, в котором происходит разрыв фосфоэфирных ковалентных связей между соседними нуклеотидами, в результате чего ДНК разделяется на фрагменты.
Сайт рестрикции EcoR1 – 6 нуклеотидов:
– Г↓ААТТЦ – (1/4)6 = 1/4096
– ЦТТАА↑Г –
Сайт рестрикции TaqI – 4 нуклеотида:
– ТЦ↓ГА – (1/4)4 = 1/256
– АГ↑ЦТ –
Характеристика сайтов рестрикции:
1. Для каждой рестриктазы свой сайт рестрикции
2. Сайты рестрикции представляют собой палиндромы, т.к. их нуклеотидная последовательность в каждой цепи читается одинаково при повороте на 180 градусов.
3. В зависимости от величины получаемых фрагментов рестриктазы 2 типа подразделяются на мелкощепящие, средещепящие и крупнощепящие. Отнести определённую рестриктазу к одному из этих классов можно путём подсчёта вероятностей встречаемости соответствующих нуклеотидов в их сайтах рестрикции.
Расчёт средней длины фрагмента:
(1/4)n
n – число пар нуклеотидов в сайте рестрикции.
4. В зависимости от мест разрывов ковалентных связей в сайте рестрикции рестриктазы делят на дающие фрагменты с липкими концами и дающие фрагменты с тупыми концами.
– Г↓ААТТЦ – → – Г + ААТТЦ –
– ЦТТАА↑Г – → – ЦТТАА + Г –
Фрагменты с липкими концами
Липкие концы представляют собой выступающие одноцепочечные участки
– ТЦ↓ГА – → – ТЦ + ГА –
– АГ↑ЦТ – → – АГ + ЦТ –
Фрагменты с тупыми концами
Ферментная активность рестриктаз измеряется в единицах активности показывающих, какое количество фермента необходимо для полного гидролиза за один час одного микрограмма ДНК фага λ при оптимальных условиях.
…, и зависят от pH, ионной силы раствора, температуры
ЛИГАЗЫ И ПРОЦЕСС ЛИГИРОВАНИЯ
Лигирование – процесс восстановления фосфоэфирных связей между соседними нуклеотидами с помощью лигаз.
1961 год – Мезейсон и Вейдон на примере фага λ показали, что рекомбинация включает разрыв и последующее воссоединения фрагментов ДНК. Это послужило началом поиска ферментов, участвующих в сшивании ДНК.
1967 год – фермент найден и назван лигаза.
ДНК лигазы в отличие от рестриктаз являются универсальными, т.е. способны образовывать связи между сахарофосфатными остовами 2 ДНК различного видового происхождения. В норме в клетке ДНК-лигаза участвует в процессе репликации, сшивая синтезированные цепи ДНК.
В генетической инженерии используется 2 типа ДНК-лигаз, отличающихся по потребностям в ко-факторах – ДНК-лигаза фага T4 и ДНК-лигаза E. coli. ДНК-лигаза E. coli в качестве ко-фактора использует дифосфопиридиннуклеотид, а ДНК-лигаза фага T4 – АТФ в присутствии ионов Mg (является более универсальной, т.к. способна соединять фрагменты как с липкими концами, так и с тупыми).
Для сшивания фрагментов РНК пользуются РНК-лигазой фага T4. Её выделяют из клеток E. coli при заражении фагом T4. Для работы РНК-лигазы в качестве ко-фактора необходима АТФ. Акцептором в реакции лигирования служит полностью дефосфорилированный участок, а донором – полностью фосфорилированный концевой участок РНК.
Соединение фрагментов ДНК с одноимёнными липкими концами чаще происходит с помощью ДНК-лигазы E. coli. Сшивание фрагментов ДНК с разноимёнными липкими концами, которые образовались под действием различных рестриктаз, производят одним из 2 способов, приводящих к затуплению разноимённых липких концов.
По первому способу затупление происходит с помощью нуклеаз, разрушающих одноцепочечные концевые участки. По второму способу – с помощью полимераз, которые достраивают по принципу комплиментарности вторую цепь на матрице выступающего участка.
Сшивание фрагментов с тупыми концами осуществляется с помощью ДНК-лигазы фага T4, однако в этом случае скорость лигирования на порядок ниже, чем при сшивании с липкими концами.
11.03.2014; Лекция 4/15
ПОЛИМЕРАЗЫ
Полимеразы – ферменты, осуществляющие матричный процесс копирования нуклеиновых кислот.
Различают ДНК-полимеразу, которая осуществляет синтез новой цепи ДНК на матрице ДНК. Применяется ДНК-полимераза в полимеразной цепной реакции (ПЦР), которую используют в генетической инженерии для амплификации ДНК.
Амплификация – наработка ДНК во множестве копий. Для амплификации используется ДНК-полимераза, выделенная из бактерии Thermus aquaticus.
В клетках в норме ДНК-полимеразы участвуют в таких матричных процессах, как: репликация ДНК, репарация ДНК.
Кроме ДНК-полимераз в генетической инженерии используется РНК-полимераза, которая способна осуществлять как в условиях in vivo, так и в условиях in vitro процесс транскрипции. Используется в редких случаях, более часто используется фермент РНК-зависимая-ДНК-полимераза (обратная транскриптаза/ревертаза) для ферментативного синтеза генов на матрице РНК.
ВЫДЕЛЕНИЕ ДНК ИЗ КЛЕТОК ДОНОРА; БАНКИ ГЕНОВ И КЛОНОТЕКИ ГЕНОМОВ
В настоящее время существуют 4 способа получения молекулы ДНК, а также фрагментов ДНК и генов:
1. Химический синтез: впервые синтез гена фенилаланиновой транспортной РНК дрожжей длиной 77 пар нуклеотидов был осуществлён в 1968 году в лаборатории Кораны; синтез генов возможен благодаря ДНК-синтезаторам, известной нуклеотидной последовательности гена, наличия соответствующих реактивов и прибор «ДНК-синтезатор»; химический синтез применяется успешно для синтеза коротких фрагментов ДНК (20-30 пар нуклеотидов) т.н. ДНК-зондов.
2. Ферментативный синтез: осуществляется с помощью фермента обратной транскриптазы на матрице однонитчатой РНК; ограничением использования этого метода является доступность зрелой и-РНК соответствующего гена.
3. Выделение из клеток донора: наиболее распространённый способ получения ДНК из клеток различных организмов, основная технология заключается в: получении культуры клеток → получении клеточных экстрактов при осаждении культур центрифугированием → добавление к экстракту лизоцима для разрушения клеточных стенок и получения сферопластов → добавление детергента для растворения мембран и инактивации гидролитических ферментов → выделение ДНК центрифугированием; в случае работы с бактериальными клетками получают 2 фракции ДНК – ДНК лёгкая и ДНК тяжёлая, эти фракции выявляются в УФ-излучении.
4. Получение из клонотеки или геномной библиотеки: под клонотекой либо генотекой ДНК понимают совокупность комплементарных ДНК по различным генам, которые включены в состав подходящего вектора (комплементарная ДНК – ДНК, лишённая интронов); геномная библиотека включает все гены генома.
Для поиска нужного исследователю гена в геномной библиотеке или клонотеке используют ДНК-зонды – короткие одноцепочечные последовательности (20-30 нуклеотидов) с радиоактивной меткой. Принцип работы ДНК-зондов основан на комплиментарности их нуклеотидной последовательности и нуклеотидной последовательности искомого гена. Метод, с помощью которого происходит поиск нужного гена получил название Саузерн-блот-гибридизация (по имени учёного Саузерна) и был разработан в 1975 году. Этот метод позволяет найти нужный ген на нитроцеллюлозной плёнке после электрофореза фрагментов ДНК. Одноцепочечные фрагменты ДНК зафиксированы на нитроцеллюлозной плёнке с помощью высокой температуре, используются в качестве компонентов поиска с помощью молекулярного зонда, который способен гибридизоваться только с определённым комплементарным фрагментов ДНК. Фрагмент, с которым связался зонд, выявляется радиоавтографией. По полученным результатам судят о присутствии интересующего гена в анализируемом геноме либо производят отбор этого гена.
РАЗДЕЛЕНИЕ ФРАГМЕНТОВ ДНК ПОСЛЕ РЕСТРИКЦИИ
Фрагменты, полученные под действием рестриктаз разделяют с помощью метода электрофореза в агарозном или полиакриламидном гелях. Метод электрофореза основан на разделении фрагментов ДНК, движущихся с различной скоростью в электрическом поле. Гель с фрагментами ДНК при этом помещают в раствор электролита и пропускают электрический ток. Электрофоретическая подвижность фрагментов линейна связана с логарифмом их относительной молекулярной массы. В растворе электролита ДНК приобретает отрицательный заряд, а её подвижность зависит от молекулярной массы. Выявление фрагмента ДНК происходит с помощью красителя бромистого этидия. Для разделения фрагментов ДНК среднего размера обычно применяют агарозный гель, в других случаях – полиакриламидный, результативность которого выше.
Лекция 5/15
РЕСТРИКЦИОННЫЕ КАРТЫ
Рестрикционные карты – физические карты молекулы ДНК, на которых нанесены сайты рестрикции для определённых рестриктаз. Рестрикционные карты строятся на основе данных гель-электрофореза.
Порядок построения рестрикционной карты:
1. Определить форму исходной молекулы ДНК
2. Определить длину исходной молекулы ДНК
3. Определить количество сайтов рестрикции, которые необходимо нанести на карту
4. Сопоставив размер рестрикционных фрагментов, полученных с помощью одной рестриктазой, с длиной рестрикционных фрагментов, полученных с помощью смеси рестриктаз, нанести сайты рестрикции на карту.
Килобаза – 1000 пар нуклеотидов.
Задача: молекула линейной ДНК была разрезана на фрагменты двумя рестриктазами (R1 и R2) и их смесью (R1+R2). Результаты электрофоретического анализа представлены на рисунке. В каком порядке полученные рестрикционные фрагменты расположены в исходной молекуле ДНК.
| R1 | R2 | R1 R2 | |||
| 10 kb | |||||
| 8 kb | |||||
| 7 kb | |||||
| 6 kb | |||||
| 3 kb | |||||
| 2 kb | |||||
| 1 kb | |||||
| Число сайтов рестрикции |
| R1 R2 R1 | |||
| Длина молекулы ДНК = 17 kb |
СИКВЕНИРОВАНИЕ ФРАГМЕНТОВ ДНК
Сиквенирование – определение нуклеотидной последовательности фрагментов ДНК с помощью одного из двух методов:
1. Химический метод/метод Максама-Гильберта (1977)
Основан на избирательной химической модификации оснований нуклеотидов, которые приводит к их разрушению.
Перед началом сиквенирования во фрагмент ДНК вводят радиоактивную метку, а затем проводят в 4 пробирках реакции по разрушению одного из 4 нуклеотидов. Результаты реакции каждой из пробирок подвергают электрофорезу. На электрофореграмме определяют на каком расстоянии от радиоактивной метки находится соответствующий нуклеотид, используя данные по разделению фрагментов ДНК в зависимости от их молекулярной массы.
2. Ферментативный метод/метод Сэнгера (1977)
Основан на репликации комплементарной цепи ДНК на одноцепочечной ДНК-матрице при происходящим в разных местах строящихся последовательностях ДНК обрыве синтеза. Обрыв синтезируемой цепи ДНК происходит путём введения терминирующих нуклеотидов. Терминирующими нуклеотидами являются дидезокситрифосфаты, которые не могут сформировать ковалентную связь со следующим нуклеотидом, поэтому происходит обрыв синтеза. Сиквенирование производят также в 4 пробирках, а результаты разделяют с помощью электрофореза, по которому и считывают нуклеотидную последовательность.
ТЕХНОЛОГИЯ РЕКОМБИНАНТНЫХ ДНК
I. ОСНОВНЫЕ ЭТАПЫ ТЕХНОЛОГИИ РЕКОМБИНАНТНЫХ ДНК
Рекомбинантная ДНК – гибридная ДНК, полученная в результате объединения 2 фрагментов (обычно чужеродных) ДНК.
1. Этап создания рекомбинантных ДНК
- выделение ДНК из клеток донора
- подготовка ДНК к клонированию
- сиквенирования фрагментов ДНК
- конструирование рекомбинантных ДНК
2. Этап введения и экспрессии рекомбинантных ДНК в клетки реципиента
- трансформация реципиентных клеток рекомбинантными ДНК
- отбор трансформированных клеток с помощью маркеров
- получение экспрессируемого белкового продукта и его анализа
- промышленное получение полипептидного препарата и его тестирование
II. ОБЩАЯ ХАРАКТЕРИСТИКА ГЕНЕТИЧЕСКИХ ВЕКТОРОВ
Вектор – молекула ДНК, способная акцептировать чужеродный фрагмент ДНК и обеспечить его репликацию, экспрессию и/или трансформацию.
Векторы, применяемые в генетической инженерии прокариот:
- плазмидные
- фаговые
- плазмидно-фаговые (космиды и фазмиды)
Общая характеристика векторов будет рассмотрена на примере плазмидного вектора.
Плазмидный вектор представляет собой кольцевую молекулу ДНК и построен на основе плазмиды (внехромосомного элемента бактериальной клетки). Вектор должен обладать:
1. Определённым размером – физическая величина, характеризующая длину его молекулы
2. Определённой ёмкостью – размером фрагмента ДНК, который может акцептировать векторной системой
3. Возможностью самореплицироваться
4. Вектор должен иметь маркерный ген
Первая векторная система для прокариот – pSC101 – была предложена для бактерий (всегда есть буква p – плазмидный вектор); примитивная, с 1 маркерным геном, с 1 сайтом рестрикции EcoR1. Его сменил вектор pBR322 – вторая векторная система; 2 маркера, множество сайтов рестрикции и наличие точки начала репликации. Современная векторная система – pUC – отличается от предыдущих наличием полилинкера (фрагмент ДНК, содержащий большое количество сайтов рестрикции для различных рестриктаз) и объединяет плазмидные векторные системы, содержащие ori-сайт – точка начала репликации плазмидной векторной системы в определённой бактериальной клетки, из которой была выделена плазмида (послужившая основой для создания плазмидного вектора).
Фаговая векторная система построена на основе ДНК бактериофага; отличается от плазмидной большей ёмкостью, т.е. может включить в свой состав чужеродную ДНК большей длины (до 20000 пар нуклеотидов).
Принципиальное строение фагового вектора сходно со строением бактериофага, т.е. имеется белковый капсид, внутри которого заключена векторная система, которая сама и производит белковый капсид, т.к. в ДНК вектора содержится левая и правая флангирующие последовательности, кодирующие белковый капсид и упаковку ДНК внутри белкового капсида.
Плазмидно-фаговые векторные системы
Гибридные векторные системы, которые подразделяются на космиды и фазмиды. Созданы с целью клонирования и трансформации генов большой длины (в среднем 40000 пар нуклеотидов).
1. Космиды
Характеризуются плазмидным типом репликации и обладают способностью упаковываться (в условиях in vitro) в головке фага λ. По существу космиды являются плазмидными векторами, имеющими лишь флангирующие последовательности – cos-участки – от бактериофага.
2. Фазмиды
Истинные гибриды плазмиды и фага, на концах которых расположены сегменты ДНК фага, а средняя часть представлена плазмидной ДНК. Фазмиды могут реплицироваться и как плазмиды, и как фаги.
Единственным ограничением на использование гибридных векторных систем является способность ДНК упаковаться в головку фаговой частицы.
Проблемы создания векторов для генетической инженерии растений
Проблема создания векторов для клеток растений была решена при исследовании заболевания корончатый галл у высших растений.
Причиной данного заболевания является бактерия Agrobacterium tumefaciens, обитающая и ризосфере растений. Эта бактерия содержит Ti-плазмиду, структура которой следующая:
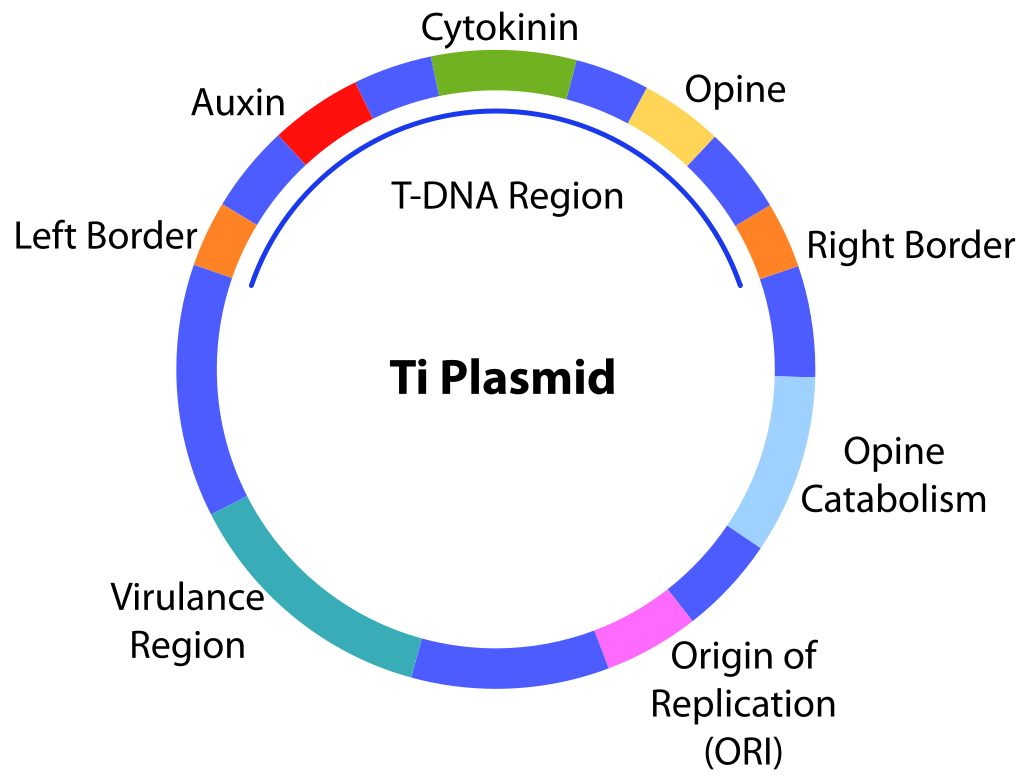
Состоит из 2 диаметров. В составе Т-ДНК – имеет левый (Left Border) и правый (Right Border) фланги; 3 гена – гены ауксина (Auxin), цитокинина (Cytokinin) и опина (Opine).
Opine Catabolism – зона катаболизма опина
ORI-сайт – точка начала репликации клеток агробактерии.
Virulance Region (VIR) – вирулентная область; в VIR-области находится 7 генов, которые отвечают за вырезание T-области ДНК, перенос её в геном растительной клетки, а также кодировку рецепторных белков, улавливающих раневые вещества, выделяемы растением.
Для использования Ti-плазмиды в качестве векторной системы производят её модификацию и чужеродный ген размером 40000 пар нуклеотидов встраивают вместо имеющихся генов T-области. В настоящее время с целью переноса генов большего размера созданы следующие векторные системы:
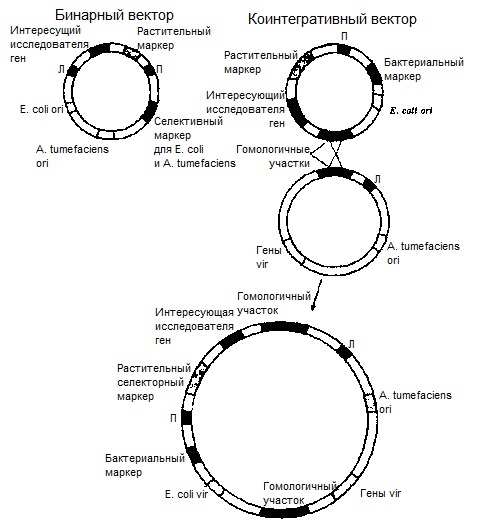
1. Коинтегративный вектор – состоит из 2-х объединённых векторов: плазмидного вектора pBR322 и неонкогенной Ti-плазмиды.
Недостаток – может быть применима только для трансформации некоторых видов растений.
2. Бинарный/челночный – состоит из 2 необъединяющихся векторов – собственно бинарного вектора (является клонирующим вектором) и неонкогенный тип плазмиды (является вектором-помощником).
Все стадии клонирования проводят в кишечной палочке, что намного упрощает весь процесс, а затем вектор вводят в агробактерию, в которой содержится неонкогенная Ti-плазмида, содержащая только ori-сайт и гены VIR-области. После этого происходит трансформация растительных клеток.
Вектора для трансформации растительных клеток создаются не только на основе Ti-плазмиды, но и на основе Ri-плазмиды, а также на основе ДНКовых вирусов растений, в частности вируса табачной мозаики, мозаики цветной капусты и других.
Ретровирусные вектора для клеток животных
Для клеток животных организмов не найдены природные плазмидные системы, поэтому вектора разрабатываются только на основе вирусов как ДНКовых, так РНКовых. В частности в качестве объектов используются ретро-вирусы – РНК-содержащие вирусы, папилломы простого герпеса. ДНК этих вирусов изменяют (избавляют от инфекционности) и производят встраивание нужного исследователю гена.
В настоящее время существую достаточно много проблем по производству векторных систем для трансформации клеток животных.
ВВЕДЕНИЕ И ЭКСПРЕССИЯ РЕКОМБИНАНТНЫХ МОЛЕКУЛ ДНК В КЛЕТКИ РЕЦИПИЕНТА
I. ГЕНЕТИЧЕСКАЯ ТРАНСФОРМАЦИЯ ПРОКАРИОТ
Трансформация – явление, предполагающее перенос ДНК не половым путём от клеток донора к клеткам реципиента.
Для прокариот разработаны методы трансформации, основанные на переносе изолированной ДНК и методы трансдукции, основанные на переносе генов с помощью бактериофага. Наибольшую разновидность имеют методы трансформации. К ним относят методы:
- прямого переноса генов, включающие конъюгацию, упаковку в липосомы (сферические образования, оболочки которых состоят из фосфолипидов; создают искусственно путём встряхивания или обработки ультразвуком водных эмульсий фосфолипидов; в липосомы заключают плазмидную векторную систему и трансформируют клетки прокариот), электропорации – основан на повышении проницаемости клеточной стенки бактерий для векторной системы за счёт действия импульсов высокого напряжения.
II. МЕТОДЫ ТРАНСФОРМАЦИИ РАСТИТЕЛЬНЫХ КЛЕТОК
Различаются в зависимости от реципиетного организма (однодольные или двудольные растения). Для двудольных растений самым распространённым методом трансформации является метод кокультивирования с агробактерией. Однако для однодольных растений он не применим, поэтому разработаны ряд методов трансформации для доставки векторных систем как в клетки, так и в протопласты; относятся методы прямого переноса генов (метод трансформации протопластов, метод микроинъекции, метод электропорации, метод упаковки в липосомы); кроме применяется метод биобаллистической трансформации.
Названные методы применяются как для трансформации клеток однодольных, так и двудольных растений.
Ограничением на использование этих методов у растений является возможность регенерации растений из клеток и протопластов.
III. МЕТОДЫ ВВЕДЕНИЯ ЧУЖЕРОДНОЙ ДНК В КЛЕТКИ ЖИВОТНЫХ
Разработанный ещё в 80-е годы метод микроинъекции животных клеток для переноса векторной системы остаётся до сегодняшнего дня основным и практически единственным методом трансформации. Этот метод имеет один большой недостаток – эффективность/производительность.
IV. ОСНОВНЫЕ ПРОБЛЕМЫ ЭКСПРЕССИИ ЧУЖЕРОДНЫХ ГЕНОВ И ПУТИ ИХ ПРЕОДОЛЕНИЯ
1. Введение в геном реципиентных клеток больших (более 10000 пар нуклеотидов) генов или несколько функциональных генов; решается путём разработки новых типов векторных систем с большой ёмкостью.
2. Придание трансгенным организмам количественных признаков, поскольку они контролируются несколькими генами; не решена.
3. Экспрессия генов эукариот в клетках прокариот; порождена различной структурой генов (экзон-интронной у эукариот и экзонной у прокариот), а также различные конструкции промоутеров, запускающие процесс экспрессии генов.
4. Регуляция интенсивности экспрессии трансгенов, связанная с чрезмерной работой гена, которая приводит к истощению ресурсов реципиентной клетки и даже её гибели, поэтому пытаются регулировать экспрессию трансгенов путём изменения температур.
ПРИКЛАДНЫЕ АСПЕКТЫ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
I. ЭТАПЫ ТЕХНОЛОГИИ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ ОРГАНИЗМОВ
1. Выбор гена и его клонирование
2. Подбор генотипа реципиента
3. Введение гена и его экспрессия в геноме реципиента
4. Особенность этого этапа связана с объектом – может быть культивирование клеток бактерий на питательных средах или регенерация растений из трансформированных клеток или развитие эмбриона в матке суррогатной матери
5. Отбор трансгенных организмов
Выбор гена зависит от целей и задач генно-инженерного исследования. Этот ген может быть достаточно удалённым от генотипа реципиента. Тем не менее генетическая инженерия обладает возможностью осуществления его экспрессии в чужеродном геноме.
Рассмотрим задачи генетической инженерии на примере создания принципиально новых форм растений (трансгенных растений).
Россия занимает 2 место (после Китая) по производству картофеля. Ежегодно народонаселением России потребляется 35 млн тонн картофеля, стоимость которого составляет 7 млрд $. При этом потеря урожая составляет: от вредителей – 18%, от болезней – 16%, от сорняков – 2%. Ежегодный займ России в МВФ составляет 2,8 млрд $.
Задачи:
1. Повысить пищевую ценность с/х растений и декоративные качества культурных растений
2. Повысить устойчивость трансгенных растений к гербицидам, вредителям, патогенам и неблагоприятным условиям окружающей среды
3. Сократить сроки выведения новых сортов
4. Уменьшение старения растений
5. Снизить технологические затраты при выращивании с/х растений и сделать растениеводство более экономически выгодными.
Формальной датой рождения генетической инженерии растений является создание с помощью Ti-плазмидного вектора химерного растения санбин, полученного при переносе гена запасного белка бобовых (фазеолина) в геном подсолнечника.
1983 год – получены первые трансгенные растения табака, устойчивые к гербицидам.
1986 год – проведены в США первые успешные полевые испытания этих растений.
1994 год – после прохождения всех необходимых тестов на токсичность, аллергенность, мутагенность в США появились в продаже первые трансгенные продукты: томаты с замедленным созреванием и гербицид-устойчивая соя.
В настоящее время более 40 видов генетические изменённых растений томатов, кукурузы, картофеля, сои, табака, рапса и других. Список трансгенных растений с новыми признаками и качествами с каждым годом расширяется.
В РБ работы по созданию трансгенных растений ведутся в небольшом объёме. Эти работы направлены на создание трансгенных растений табака, как модельного объекта, и трансгенных растений картофеля. Создаются растения для биоремедиация, т.е. способные расти на почвах, загрязнённых тяжёлыми металлами и нефтепродуктами.
Особый интерес представляет возможность создания трансгенных растений, синтезирующих белок цитохром, который катализирует превращение холестерина в прегнеголохолестерин – предшественник стероидных гормонов у животных. В качестве реципиетного растения используется рапс.
Перспективность трансгенных растений связана с:
1. Созданием новых ценных сортов растений, устойчивых к различным заболеваниям и неблагоприятным факторами внешней среды
2. Разработкой методов биологической фиксации азота
3. Повышением продуктивности с/х культур
4. Увеличением производительности на тех же площадях пахотных земель
5. Уменьшением ущерба окружающей среде от использования ядохимикатов
6. Экономическая выгода
II. ОСНОВНЫЕ ТРЕБОВАНИЯ К БИОБЕЗОПАСНОСТИ БИОИНЖЕНЕРНЫХ ТЕХНОЛОГИЙ
В РБ, как и в других странах, имеется законодательная база, регулирующая вопросы биобезопасности:
1. Постановление Совета министров РБ от 19.06.1998 «О создании национального координационного центра биобезопасности»
2. Закон РБ от 6.05.2002 «О присоединении РБ к Картафенскому договору по биобезопасности, к Конвенции о биологическом разнообразии»
3. Закон РБ от 29.06.2003 «О качестве и безопасности продовольственного сырья и пищевых продуктов для жизни и здоровья человека»
III. НЕРЕШЁННЫЕ ПРОБЛЕМЫ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
1. Перенос более одного трансгена в клетки реципиента
2. Придание или улучшение у трансгенных растений количественных признаков
3. Экспрессия эукариотических генов в прокариотических организмах, и наоборот
4. Проблема создания векторов для трансформации клеток животных
5. Замолкаемость трансгенов в трансгенном геноме через некоторое время
СЫРЬЕВАЯ БАЗА БИОТЕХНОЛОГИИ
Промышленная биотехнология использует протекающие в живых организмах биологические процессы и направляет их на переработку сырья с целью получения нужных человеку продуктов.
Сырьё → Механизм переработки → Продукт
Принципиальным отличием промышленной биотехнологии является её целевой продукт, который может быть в виде:
1. Биомассы, т.е. клеточные массы микроорганизмов, образующиеся в результате их жизнедеятельности и размножения
2. В Виде продукта метаболизма (белки, ферменты, аминокислоты, полисахариды, антибиотики, витамины и другие), которые выделяются из клеток микроорганизмов либо клеток растений и животных.
Примером перового промышленного биотехнологического производства является производство глютаминовой кислоты, организованная в 1956 году в Токио. Сырьё: альфакетоглутароновая кислота, возникающая в цикле Кребса. Получается при переработке бактериями углеводного сырья. Механизм переработки: культивирование бревибактерий и коринебактерий в ферментерах и биореакторах. Продукт – глютаминовая кислота в концентрации 30 г/л.
Глютаминовая кислота является усилителем вкуса, а также препаратом для лечения психических заболеваний. На её долю в мировом производстве среди аминокислот приходится 60% (~ 300000 тонн в год). В целом среди продуктов, получаемых с помощью промышленной биотехнологии, первое место по объёму производства занимают аминокислоты, которые находятся на 2 месте по стоимости производства (после антибиотиков).
I. ОСНОВНЫЕ ТИПЫ ПИТАТЕЛЬНЫХ СРЕД И ИХ ХАРАКТЕРИСТИКА
Питательные среды (субстраты) применяются для выращивания объектов биотехнологии (продуцентов) и призваны обеспечить их жизнедеятельность, рост и развитие, а также синтез целевого продукта с максимальной эффективностью.
Требования, предъявляемые к питательным средам такие же, как и в микробиологии:
1. Питательная среда должна содержать все необходимые для роста питательные вещества в легко усваиваемой форме
2. Питательная среда должна иметь оптимальную влажность, вязкость, pH, быть сбалансированной и, по возможности, прозрачной
3. Компонентный состав определяется питательными потребностями продуцента. В связи с этим универсальных питательных сред не существует, однако основными компонентами любой питательной среды для культивирования микроорганизмов является источники углерода и азота. В качестве источников углерода используют главным образом природные комплексные соединения – отходы различных производств, продукты переработки растительного сырья, компонент из сточных вод и другие. Вышеперечисленные среды называются комплексными, поскольку помимо углеродных соединений содержат минеральные вещества и ростовые компоненты. Минеральные вещества необходимы для роста микроорганизмов и подразделяются на макро- и микроэлементы. Среди макроэлементов на 1 месте стоит азот – обычно используется микроорганизмами в восстановленной форме (мочевина), аммоний или их соли. Часто азот входит в комплексе с фосфором и серой в состав комплексных компонентов. Важным является сбалансированность питательных сред в отношении углерода к азоту, поскольку это воздействует на скорость роста продуцентов, их метаболизм и синтез целевых продуктов. К ростовым факторам питательных сред относят витамины, отдельные аминокислоты и другие. Эти ростовые факторы могут быть внесены в среду в чистом виде, либо в составе ростовых добавок, которыми являются кукурузный или дрожжевой экстракт, экстракт проростков ячменя, картофельный сок и другие.
II. ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ ФЕРМЕНТАЦИОННЫХ ПРОЦЕССОВ
Ферментация – процесс, в котором происходит преобразование исходного сырья в продукт с использованием деятельности микроорганизмов или изолированных клеток. Синонимами слова ферментация является культивирование, выращивание микроорганизмов и биосинтез.
По целевому продукту различают следующие типы ферментации:
1. Ферментация, в которой целевым продуктом является сама биомасса микроорганизмов, поэтому такие процессы называют культивированием или выращиванием
2. Ферментация, в которой целевым продуктом является первичный или вторичный метаболит; такие процессы называют биосинтезом.
Задачей ферментации является не только получение нужного продукта, но и утилизация определённых компонентов питательной среды. К таким процессам относятся биоокисление, метановое брожение, биодеградация.
Исходную среду в процессах ферментации обозначают как субстрат.
Сырьё для процессов ферментации, прежде всего, решает проблему формирования питательных сред, в которых должны содержаться все необходимые компоненты для построения биомассы микроорганизмов. В тоже время среда является основой для обитания микроорганизмов. Основным видом сырья является вода. Так, при производстве 1 тонны пекарских дрожжей расходуется от 150 до 180 м3 воды. Кроме того многие виды продуктов биотехнологических производств определяются качеством воды.
По физическому состоянию среды могут быть твёрдыми (на основе агар-агара, желатина), жидкими (на основе воды) и сыпучими (отруби, солома, зерно, опилки).
По составу питательные среды могут быть натуральными и синтетическими.
Натуральные среды включают в себя продукты животного и растительного происхождения, являются сложными и непостоянными по составу.
Синтетические среды составляются из определённых химических соединений, число которых обычно небольшое. Как правило, они более дорогие и менее продуктивные.
III. ПРИРОДНЫЕ СРЕДЫ И СУБСТАРЫ, ОТХОДЫ ПРОИЗВОДСТВА ДЛЯ КУЛЬТИВИРОВАНИЯ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
Источником природного сырья является сельское хозяйство и отрасли лесоводства. Получаемые в этих отраслях материалы представляют собой соединения различной химической сложности и включают сахара, крахмал, целлюлозу, гемицеллюлозу и лигнин.
Наиболее подходящим и доступным питательным субстратом для биотехнологических процессов является сырьё, используемое в производстве сахара – сахарный тростник и сахарная свёкла. Существенную значимость представляют крахмалосодержащие с/х продукты, включающие различные злаки, картофель и другие корнеплоды; содержащихся в них крахмал обладает одним недостатком – он является полисахаридом, поэтому должен быть переведен до моно-, либо олигосахаров, доступных для микроорганизмов. Целлюлоза составляет половину высушенной растительной массы как с/х, так и лесного производства и является ценнейшим источником энергии и углерода; она представляет собой наиболее распространённый и возобновляемый источник сырья, однако должны быть преодолены технологические трудности, прежде чем окажется выгодным использование целлюлозы; трудности связаны с процессом предобработки целлюлозы, который разрушается путём химического или ферментативного гидролиза до растворимых сахаров, которые, в свою очередь, легко подвергаются ферментации микроорганизмами с образованием этанола, бутанола, ацетона, одноклеточного белка, метана и других продуктов.
В биотехнологии большое внимание также уделяется и другим видам растительной массы – плодам с соком, клубням, травяной массе, которые являются источниками растительного природного сырья. На ровне с этим одной из главных задач биотехнологии является максимальное использование огромных объёмов органических отходов; их утилизация обеспечивает удаление источников загрязнения, а также обусловит превращение этих отходов в полезные целевые продукты. В качестве таких отходов в биотехнологии широко используются отходы с/х, деревообрабатывающей, бумажной и пищевой промышленности. В настоящее время на основе этих отходов (меласса/чёрная патока, молочная сыворотка и другие) осуществляется ферментационным процессом.
ТЕХНОЛОГИИ ФЕРМЕНТАЦИОННЫХ ПРОЦЕССОВ
I. УСТРОЙСТВО ФЕРМЕНТЕРОВ И БИОРЕАКТОРОВ И СИСТЕМЫ, ИСПОЛЬЗУЕМЫЕ В НИХ
Ферментеры (ферментаторы/биореакторы) представляют собой камеры, в которых в жидкой или на твёрдой среде выращивают микроорганизмы.
Процесс, происходящий в ферментере – ферментация.
Различают 2 основных типа ферментеров: первый предназначен для культивирования микрообъектов в аэрируемых условиях, а второй – в бескислородных условиях.
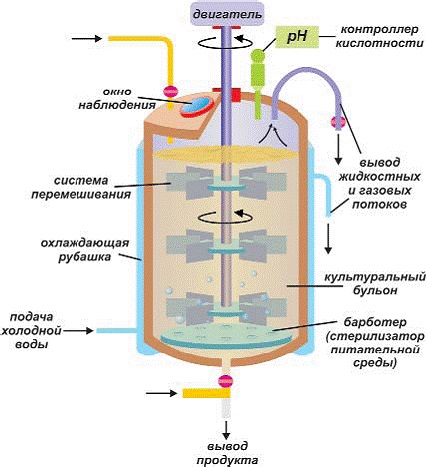
Современные биореакторы – многофункциональные устройства, которые должны обладать следующими свойствами:
1. Эффективного перемешивания и гомогенизации питательной среды
2. Обеспечение свободной и быстрой диффузии газообразных компонентов аэрируемой среды
3. Теплообмен, обеспечивающий поддержание температуры внутри реактора
4. Пеногашение
5. Стерилизации
6. Контроль и регулировка процесса ферментации
Главное требование, предъявляемое к ферментерам – сохранение стерильности, поэтому они должны быть герметичными, а все линии трубопровода должны быть доступны для обработки горячим паром.
Рабочий объём ферментатора – не более 0,7 от общего объёма ферментов.
Конструкторские различия биореакторов определяются в основном способами подвода энергии и аэрации среды. Различают:
1. Ферментеры с подводом энергии к газовой фазе – ФГ; в них для аэрации и перемешивания питательной среды используется сжатый воздух, подаваемый с высокой скоростью и под определённым давлением; в этих аппаратах отсутствуют системы механического перемешивания; в них проще поддерживать асептические условия; недостатком является низкая скорость массообмена по сравнению с биореакторами, в которых используется механическое перемешивание; ферментеры типа ФГ используются для производства белка одноклеточных.
2. В производстве кормового белка широкое распространение получили ферментеры с мешалками, в которых подвод энергии осуществляется в жидкой фазе – ферментеры типа ФЖ; этот тип представляет собой вертикальный цилиндр, снабжённый циркуляционными, теплообменными и аэрирующими устройствами; теплообменные устройства выполнены в виде трубок, которые установлены в трубных решётках.
3. В аппаратах типа ФЖГ осуществляется комбинированный подбор энергии к газовой фазе для аэрации и к жидкой фазе для перемешивания; ферментер снабжается механической мешалкой и системой аэрации. Одним из положительных моментов является длительное (до нескольких суток) поддержание стерильности при оптимальных условиях для роста и жизнедеятельности продуцентов; такие ферментеры применяются в производстве антибиотиков и витаминов.
Во время ферментации возникают некоторые трудности, которые преодолеваются с помощью определённых систем. Серьёзной проблемой является пенообразование, связанное с необходимостью аэрирования питательной среды, в которой присутствуют поверхностно-активные вещества, как продукты распада жиров, и белки (компоненты питательной среды). Образующийся слой пены с одной стороны способствует росту аэробных микроорганизмов, а с другой стороны сокращает полезный объём биореактора, тем самым способствует заражению продуцентов посторонней микрофлорой. Это заставляет разрабатывать системы пеногашения, как средств борьбы с избыточным пенообразованием. В настоящее время разработаны химические, механические, акустические типы пеногашения. Наиболее часто используются химические и механические.
К химическим относятся поверхностно-активные вещества, которые способны внедрятся в стенки пузырей, становясь их центрами неустойчивости (растительные масла, животные жиры). Недостатком химического пеногашения является то, что используемые химические вещества могут быть утилизированы микроорганизмами и тем самым по себе становятся источником пенообразования.
Механические пеногасители представляют собой устройства, сбивающие пену: диски, лопасти, барабаны и другие, которые располагаются обычно в верхней части реактора. Используются также сепараторы пены, которые одновременно служат и для сбора биомассы микроорганизмов, содержащихся в пене.
Крайне важным моментом при работе биореакторы является обеспечение должного уровня теплообмена, поскольку жизнедеятельность и метаболическая активность продуцентов очень сильно зависит от колебания температур. Температурный оптимум зависит от вида микроорганизма, но чаще находится в пределах 30-50 градусов Цельсия. Теплообмен поддерживается с помощью рубашки биореактора. В качестве нагревающего или охлаждающего агента выступает вода.
Система аэрации зачастую бывает сложной конструкции, поскольку должна обеспечить доступ воздуха с определённым количество О2, поддержать баланс О2 и СО2 во время ферментации и отвод отработанных газов их реактора, при этом большое внимание уделяется обеззараживанию воздуха – для этого используют полипропиленовые мембраны, которые хорошо себя закоремендовали при промышленном получении интерферона.
Для эффективной работы биореактора необходимо осуществить перемешивание его содержимого с целью сохранения равномерной температуры во всём объёме, а также эффективному использованию компонентов питательной среды и отводу продуктов метаболизма. В качестве перемешивающих устройств используют механические мешалки, при этом они могут быть многоярусные и к внутренним стенкам биореактора прикрепляют отражающие перегородки, которые предотвращают возникновение водоворотов и обеспечивают вихревое движение жидкости. Однако в ряде продуцентов (мицелярные грибы) использование мешалок сопряжено с их обрастанием мицелием грибов. Поэтому предусматривают системы периодического перемешивания на разных скоростях.
II. СПЕЦИАЛИЗИРОВАННЫЕ ФЕРМЕНТАЦИОННЫЕ ТЕХНОЛОГИИ
Большинство ферментационных технологий связано с жидкими аэрируемыми системами. Однако, в настоящее время достаточно широко используются ферментационные технологии, основанные на утилизации плотных субстратов при отсутствии либо малом количестве воды, а также в бескислородных условиях.
1. Аэробная ферментационная технология
Связана с проведением процесса ферментации в аэрируемых условиях.
2. Анаэробная ферментационная технология
Сопровождается проведением ферментации, во время которой в качестве подаваемых газов выступает водород, метан, но не кислород. Газофазные процессы осуществляются в аппаратах с твёрдым наполнителем. В таких аппаратах получают спирт на основе дрожжей, а также биомассу дрожжей.
3. Твёрдофазные ферментационные технологии
Осуществляются на основе растительного сырья и в качестве продуцентов используются мицелярные грибы, дрожжи или их комбинация. Различают 3 типа твёрдофазных процессов:
1) Поверхностное культивирование продуцентов на субстрате, слой которого не превышает 7 см – тонкий слой; в этом типе процессов в качестве биореакторов используются большие (до нескольких м2) подносы или культуральные камеры.
2) Глубинные процессы, идущие в не перемешиваемом слое – высокий слой, при этом биореакторы представляют собой глубокие открытые сосуды; для аэрирования разработаны приспособления, обеспечивающие конвекционный и диффузионный газообмен.
3) Перемешиваемые процессы – протекают в перемешиваемой аэрируемой массе субстрата, который может быть гомогенным полужидкой консистенция или состоять из частиц твёрдого вещества, взвешенных в жидкости; для этого обычно используют биореакторы с низкоскоростным перемешивание.
В целом интерес к твёрдофазным процессам обусловлен их некоторыми преимуществами по сравнению с процессами, осуществляемыми в жидкой фазе. В числе преимуществ можно назвать следующее:
1. Твёрдофазная ферментация требует меньшие затраты энергии и на оснащение и эксплуатацию
2. Характер субстрата облегчает отделение и очистку продукта
3. Низкое содержание воды препятствует заражению культуры продуцента посторонней микрофлорой
4. Твёрдофазные процессы не связаны со сбросом в окружающую среду больших количеств сточных вод.
Однако на названные преимущества существуют и некоторые проблемы, связанные с отсутствием хорошего перемешивания продуцента, поэтому он растёт в виде колоний и лишь постепенно может распространяться по субстрату; при этом возникает локальная недостача питательных веществ. При этом часть субстрата вообще не используется продуцентами
III. ТИПЫ И РЕЖИМ ФЕРМЕНТАЦИИ
Существуют 2 основных типа ферментации – периодическая ферментация (или закрытая система) и непрерывное культивирование (или открытая система).
При периодической ферментации все необходимые ингредиенты вносятся до начала процесса, в ходе культивирования питательные вещества не добавляются и параметры ферментации не меняются; именно поэтому процесс называют закрытой системой; когда образуется достаточное количество продукта, процесс останавливают, содержимое ферментера выгружают, выделяют продукт, выбрасывают использованные микроорганизмы, чистят ферментер и загружают его для нового культивирования.
Непрерывное культивирование представляет собой продолжительную долговременную операцию, занимающую много недель, в ходе которой питательные вещества добавляют в среду по мере их расходования, а излишек культуры отбирают; не смотря на то, что данный тип ферментации является близки к естественным условиям, как, например, в кишечнике животные, непрерывное культивирование имеет ограниченное применение, в частности используется при производстве белка рутина из бактерий: продолжительность ферментации – 100 дней, а производительность – 150 тонн в день. Непрерывное культивирование пока не находит широкого применения, однако в настоящее время всё более популярным становится применение компромиссной системы между двумя типами ферментации, а именно использование периодического культивирования с добавление субстрата в определённый промежуток времени, при этом период роста продуцента удлиняется за счёт того, что питательные вещества добавляются в низких концентрациях в процессе ферментации, а не вносится в питательную среду до начала процесса. Одним из преимуществ комбинированной системы является регулирование скорости роста, который соизмеряют со скоростью подачи кислорода. Обычно этот процесс используется в производстве дрожжевых клеток в пекарной промышленности. Если к дрожжевым клеткам добавляют много сахара, то они начинают дышать анаэробно и образуют вместо биомассы спирт. Широко используется периодическое культивирование и в производстве антибиотиков.
Во время культивирования микроорганизмы поддерживаются в экспоненциальной фазе роста – с этой целью в биореактор непрерывно подаётся питательная среда, при этом обеспечивается отток культуральной жидкости, содержащие микроорганизмы и продукты их жизнедеятельности. Основным принципом работы комбинированной системы является точное соблюдение равновесия между приростом биомассы продуцента (в следствии деления клеток) и их убылью (в результате разбавления содержимого свежей средой).
Различают 2 режима ферментации – хемостатный и турбидостатный. При хемостатном режиме саморегулируемая система возникает в силу следующих причин:
1. Если первоначальное поступление питательной среды и вымывание биомассы превышает скорость деления клеток, то в результате разбавления культуры снижается концентрация веществ, обеспечивающие ростовые процессы и скорость роста культуры повышается
2. Если увеличивающаяся культура начинает активно выедать субстрат, то это приводит к торможению роста культуры.
Конечным итого ферментации в хемостатном режиме является установление равновесия между скоростью роста культуры и её разбавления.
При турбидостатном режиме культивирование базируется на прямом контроле концентрации биомассы. Наиболее распространённым методом её определения является светорассеивание с помощью фотоэлементов; так повышение концентрации клеток и, соответственно, оптической плотности автоматически ускоряет проток жидкости, и наоборот.
Хемостатный режим применяется в процессах, характеризующихся малым протоком, когда концентрация клеток изменяется незначительно с изменением скорости протока, что облегчает саморегулировку системы.
Турбидостатный режим используется в процессах с высокой скоростью разбавления, которые обусловливают быстрое и резкое изменение концентрации биомассы.
IV. ПРИНЦИП МАСШТАБИРОВАНИЯ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Технология производственного процесса отрабатывается поэтапно в лабораторных, пилотных и промышленных установках. На каждом этапе используются ферментеры различных объёмов: на лабораторном этапе – от 0,5 до 100 литров, на пилотном этапе – от 100 до 5000 литров, на промышленном этапе – от 5000 до 1000000 литров.
Увеличение объёмов и масштабы ферментации называется масштабированием, при этом решаются конкретные задачи налаживания производства и его оптимизации.
Лабораторные ферментеры по устройству и форме напоминают промышленные и подразделяются на те же типы. По принципу теплообмена и стерилизации они делятся на 2 категории:
1. Лишённые собственных систем теплообмена и стерилизации – такие аппараты, по сути дела, представляют собой камеры для культивирования, помещаемые в водяные бани и стерилизуемые в автоклавах.
2. Снабжены системами теплообмена и стерилизации, которые принципиально не отличаются от промышленных.
С помощью лабораторных ферментеров решаются следующие задачи:
1. Кинетические – связанные с определением скорости роста клеток, эффективности утилизации субстрата и образова
| <== предыдущая страница | | | следующая страница ==> |
| ПРАКТИЧЕКАЯ РАБОТА № 6 | | | Другие названия: скумпия коггигрия, желтинник, скумпия обыкновенная |
Дата добавления: 2014-10-17; просмотров: 2635; Нарушение авторских прав

Мы поможем в написании ваших работ!