
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Диаграмма состояния сплавов, имеющих неограниченную растворимость в жидком, твёрдом состоянии. Правило отрезков
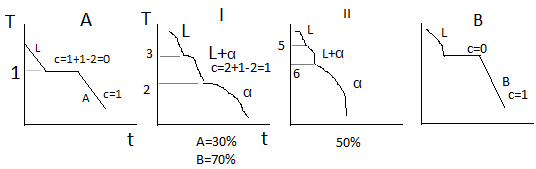
Верхняя линяя на диаграмме 1-3-5-6 – линия начала кристаллизации – Ликвидус. Линия 1-2-4-6 – линия окончания кристаллизации – линия Солидус. Выше линии Ликвидус существует только жидкая фаза L. Между линиями ликвидус и солиус идёт процесс кристаллизации и в равновесии находятся 2 фазы, т.е.число степеней свободы с=2+1-2=1. Ниже линии солидус – все сплавы однофазны и состоят из α-твёрдого раствора. Такую диаграмму состояния имеют следующие сплавы: Cu-Ni, Cu-Pt, Au-Ag, Fe-Va, Fe-Ni, Mo-W.
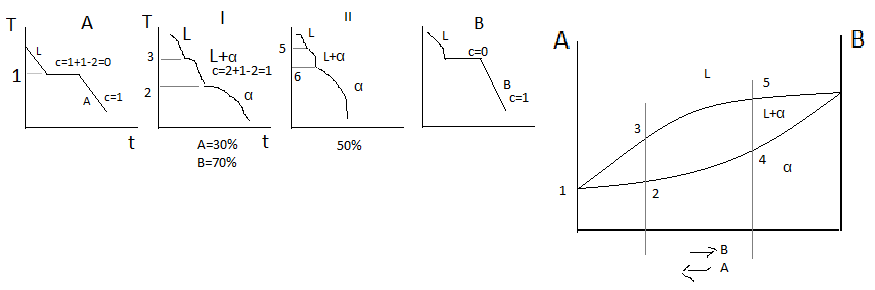 Рассмотрим более подробно процесс кристаллизации сплава 50% А 50% В. Кристаллизация начинается при температуре T1, когда из жидкого раствора выделяются первые кристаллы α-твёрдого раствора. Ниже температуры T1 сплав 2х фазный (L+α). В процессе кристаллизации твёрдых растворов состав твёрдой и жидкой фазы меняется. Каждой температуре соответствует определённое количество и концентрация фаз. В реальных условиях или при быстром охлаждении не успевает произойти выравнивание концентрации в твёрдом растворе. Даже в пределах 1-го кристалла будет наблюдаться неоднородный химический состав. Первые кристаллы α-твёрдого раствора обогащены компонентом В, а далее всё время меняется соотношение А и В. И последние кристаллы будут содержать больше компонента А.
Рассмотрим более подробно процесс кристаллизации сплава 50% А 50% В. Кристаллизация начинается при температуре T1, когда из жидкого раствора выделяются первые кристаллы α-твёрдого раствора. Ниже температуры T1 сплав 2х фазный (L+α). В процессе кристаллизации твёрдых растворов состав твёрдой и жидкой фазы меняется. Каждой температуре соответствует определённое количество и концентрация фаз. В реальных условиях или при быстром охлаждении не успевает произойти выравнивание концентрации в твёрдом растворе. Даже в пределах 1-го кристалла будет наблюдаться неоднородный химический состав. Первые кристаллы α-твёрдого раствора обогащены компонентом В, а далее всё время меняется соотношение А и В. И последние кристаллы будут содержать больше компонента А.
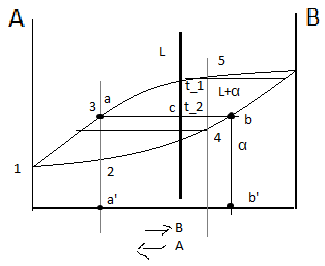 Итак, для определения количественного соотношения фаз, находящихся в равновесии при данной температуре, пользуются правилом отрезков (рычага).
Итак, для определения количественного соотношения фаз, находящихся в равновесии при данной температуре, пользуются правилом отрезков (рычага).
Правило отрезков позволяет определить: Состав фаз или концентрацию компонентов в соответствующих фазах. Для этого точки пересечения коноды с линиями диаграммы переносятся на ось концентрации, т.е. конода параллельна линии концентрации. Конода – линия, соединяющая состав фаз, находящихся в равновесии. a' – состав жидкой фазы, b’ – состав α-твёрдого раствора. Количество фаз: 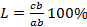
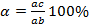 . Если точка, показывающая состав при данной температуре, т.е. линия ниже линии ликвидуса и выше линии солидуса, а её состав соответствует исходному составу.
. Если точка, показывающая состав при данной температуре, т.е. линия ниже линии ликвидуса и выше линии солидуса, а её состав соответствует исходному составу.
4.  Равновесная диаграмма состояния сплавов, образующих твердые растворы с неограниченной растворимостью.
Равновесная диаграмма состояния сплавов, образующих твердые растворы с неограниченной растворимостью.
Верхняя линяя на диаграмме 1-3-5-6 – линия начала кристаллизации – Ликвидус. Линия 1-2-4-6 – линия окончания кристаллизации – линия Солидус. Выше линии Ликвидус существует только жидкая фаза L. Между линиями ликвидус и солиус идёт процесс кристаллизации и в равновесии находятся 2 фазы, т.е.число степеней свободы с=2+1-2=1. Ниже линии солидус – все сплавы однофазны и состоят из α-твёрдого раствора. Такую диаграмму состояния имеют следующие сплавы: Cu-Ni, Cu-Pt, Au-Ag, Fe-Va, Fe-Ni, Mo-W.
 Рассмотрим более подробно процесс кристаллизации сплава 50% А 50% В. Кристаллизация начинается при температуре T1, когда из жидкого раствора выделяются первые кристаллы α-твёрдого раствора. Ниже температуры T1 сплав 2х фазный (L+α). В процессе кристаллизации твёрдых растворов состав твёрдой и жидкой фазы меняется. Каждой температуре соответствует определённое количество и концентрация фаз. В реальных условиях или при быстром охлаждении не успевает произойти выравнивание концентрации в твёрдом растворе. Даже в пределах 1-го кристалла будет наблюдаться неоднородный химический состав. Первые кристаллы α-твёрдого раствора обогащены компонентом В, а далее всё время меняется соотношение А и В. И последние кристаллы будут содержать больше компонента А.
Рассмотрим более подробно процесс кристаллизации сплава 50% А 50% В. Кристаллизация начинается при температуре T1, когда из жидкого раствора выделяются первые кристаллы α-твёрдого раствора. Ниже температуры T1 сплав 2х фазный (L+α). В процессе кристаллизации твёрдых растворов состав твёрдой и жидкой фазы меняется. Каждой температуре соответствует определённое количество и концентрация фаз. В реальных условиях или при быстром охлаждении не успевает произойти выравнивание концентрации в твёрдом растворе. Даже в пределах 1-го кристалла будет наблюдаться неоднородный химический состав. Первые кристаллы α-твёрдого раствора обогащены компонентом В, а далее всё время меняется соотношение А и В. И последние кристаллы будут содержать больше компонента А.
 Итак, для определения количественного соотношения фаз, находящихся в равновесии при данной температуре, пользуются правилом отрезков (рычага).
Итак, для определения количественного соотношения фаз, находящихся в равновесии при данной температуре, пользуются правилом отрезков (рычага).
Правило отрезков позволяет определить: Состав фаз или концентрацию компонентов в соответствующих фазах. Для этого точки пересечения коноды с линиями диаграммы переносятся на ось концентрации, т.е. конода параллельна линии концентрации. Конода – линия, соединяющая состав фаз, находящихся в равновесии. a' – состав жидкой фазы, b’ – состав α-твёрдого раствора. Количество фаз: 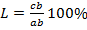
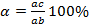 . Если точка, показывающая состав при данной температуре, т.е. линия ниже линии ликвидуса и выше линии солидуса, а её состав соответствует исходному составу.
. Если точка, показывающая состав при данной температуре, т.е. линия ниже линии ликвидуса и выше линии солидуса, а её состав соответствует исходному составу.
5. Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твердом состоянии и образуют эвтектику.
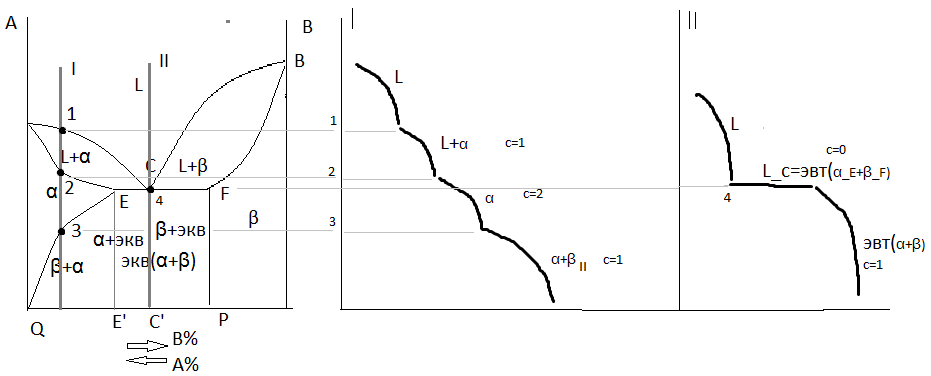
В этой системе из жидкости (L) выделяются только твёрдые растворы α или β. Около вертикалей А и В соответствующих чистому компоненту находятся области существования твёрдого раствора α и β. Α – это твёрдый раствор компонента В в А. β – твёрдый раствор А в В. ЕСF – линия эвтектического превращения.
В точке  . Линия ACB – линия ликвидус, АEFB – солидус. Предельная растворимость В в А определяется линией EQ.
. Линия ACB – линия ликвидус, АEFB – солидус. Предельная растворимость В в А определяется линией EQ.
А Компонента А в В – FP. Сплавы между EQ и FP – двух фазные, состоят из фаз α+β. Окончание кристаллизации происходит по эвтектической реакции. Сплавы в интервале концентрации E’C’ – доэвтектические сплавы. После точки С – заэвтектические. Линия EQ – линия ограниченной растворимости компонента В в α-твёрдом растворе.
В точке 3 при снижении температуры растворимость компонента В в α-растворе уменьшается, и начинает выделяться β-вторичная фаза. При эвтектической температуре растворимость β в α максимальна и составляет концентрацию E’. С понижением температуры концентрация β в α меняется до концентрации Q.
6. Компоненты и фазы в системе железо-углерод.
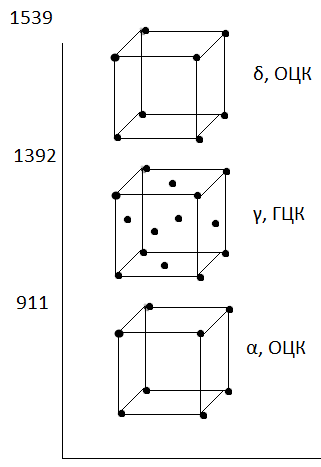
Сталь – сплав железа с содержанием углерода до 2,14%, чугуны – сплавы железа с углерода от 2,14% до 6,67%.
Компоненты и фазы в системе Fe-C:
1. Fe – металл, Т_плав = 1539 С. Имеет 2 полиморфные модификации: ->
2. С. Плотность – 2,5 грамм на сантиметр кубический. В природе в двух модификациях – алмаз и графит.
В системе Fe-C есть фазы: феррит, аустенит, цементит, графит, жидкая фаза.
Феррит – это твёрдый раствор внедрения (обозначается Ф или α) – твёрдый раствор внедрения в 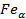 . Предельная растворимость при комнатной температуре составляет 0,006%. При температуре 727 - 0,025%. Высокотемпературная δ-фаза – твёрдый раствор, содержащий максимум C = 0,1%. Феррит обладает не большой твёрдостью. (по Бринеллю – 80-100 НВ). И обладает высокой пластичностью δ=50%.
. Предельная растворимость при комнатной температуре составляет 0,006%. При температуре 727 - 0,025%. Высокотемпературная δ-фаза – твёрдый раствор, содержащий максимум C = 0,1%. Феррит обладает не большой твёрдостью. (по Бринеллю – 80-100 НВ). И обладает высокой пластичностью δ=50%.
Аустенит обозначается А на диаграммах или γ или 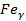 . Твёрдый раствор внедрения в γ-железе, т.е. в решётке ГЦК. Предельная растворимость С в аусцените: 2,14%.
. Твёрдый раствор внедрения в γ-железе, т.е. в решётке ГЦК. Предельная растворимость С в аусцените: 2,14%.
Цементит. Обозначается  . Очень твёрдая фаза. Имеет ромбоэдрическую решётку. Максимальное содержание – 6,67% (С). Соединение не устойчивое и при определённых условиях распадается с образованием свободного С в виде графите. Графит имеет гексагональную решётку.
. Очень твёрдая фаза. Имеет ромбоэдрическую решётку. Максимальное содержание – 6,67% (С). Соединение не устойчивое и при определённых условиях распадается с образованием свободного С в виде графите. Графит имеет гексагональную решётку.
| <== предыдущая страница | | | следующая страница ==> |
| Проблемы торговой политики | | | Диаграмма состояния системы Fe-C |
Дата добавления: 2014-11-06; просмотров: 867; Нарушение авторских прав

Мы поможем в написании ваших работ!