
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
УРАВНЕНИЕ КЛАУЗИУСА-КЛАПЕЙРОНА
ПРАВИЛО ФАЗ ГИББСА
Рассмотрим равновесную термодинамическую систему, состоящую из Ф фаз, каждая из которых содержит К компонентов. Примем в качестве параметров, определяющих состояние системы, температуру, давление и концентрацию компонентов и оценим общее число этих параметров. Число параметров одинаковых во всех фазах равно 2 - ( Т и Р).Если концентрации компонентов выражены в мольных долях, то для характеристики состава одной фазы достаточно знать (К - 1) концентраций.
Для характеристики состава всех фаз необходимо знать Ф(К - 1) концентраций. Тогда общее число параметров, определяющих состояние системы, будет равно Ф(К - 1) + 2 .
Число уравнений, связывающих концентрации компонентов, можно определить из равенства химических потенциалов каждого компонента
во всех фазах.
m11 = m12 = m13 = .........= m1ф
m21 = m22 = m23 = .........= m2ф
........................................... . К
mк1 = mк2 = mк3 = ...... ..= mкф
________________________________
Ф - 1
Число уравнений, связывающих концентрации всех компонентов равно К(Ф - 1).
Число независимых параметров системы, т. е. число термодинамических степеней свободы равно разности между общим числом параметров, определяющих состояние системы и числом уравнений, связывающих эти параметры.
С = Ф(К - 1) + 2 - К(Ф - 1)
С = К + 2 – Ф
Правило фаз - в равновесной термодинамической системе, на которую из внешних факторов оказывают влияние только температура и давление, число термодинамических степеней свободы равно числу компонентов минус число фаз плюс два.
Рассмотрим равновесие чистого вещества в двух фазах однокомпонентной системы при превращении одной фазы в другую.
dm(a) = - S(a) dT + V(a) dP
dm(b) = - S(b) dT + V(b) dP
dm(a) = dm(b)
- S(a) dT + V(a) dP = - S(b) dT + V(b) dP
( S(b) - S(a) ) dT = (V(b) - V(a) ) dP
) dP
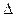 S dT = DV dP
S dT = DV dP
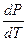 =
= 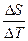
DS = 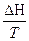 =
= 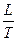
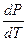 =
= 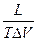
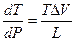
На примере воды
а) плавление - кристаллизация
a - лед b - жидкость
Lпл > 0
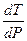 =
= 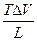
DV < 0 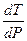 < 0
< 0

P

 T
T
б) испарение
Vпара >> V ж V = 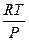
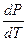 =
= 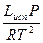 2
2
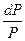 = Lисп
= Lисп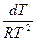

dlnP = Lисп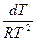

lnP = - 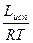 + const
+ const

 P
P
 |
T
в) возгонка
Lвозг = Lпл + Lисп
 |

 Р
Р
Т
Интегрирование уравнения от Р1 до Р2 и Т1 до Т2
ln 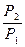 = DH/R (
= DH/R (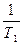 -
- 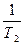 )
)
| <== предыдущая страница | | | следующая страница ==> |
| УСЛОВИЯ ФАЗОВОГО РАВНОВЕСИЯ | | | СИСТЕМА С НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ |
Дата добавления: 2014-03-11; просмотров: 333; Нарушение авторских прав

Мы поможем в написании ваших работ!