
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ОСНОВЫ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Ф. И. Гротгус (1805) высказал мнение, что в растворах электролитов электричество переносится свободными ионами. При этом он предполагал, распад частиц на ионы происходит под действием электрического тока.
Р. Э. Ленц (1878) предположил, что молекулы растворяемых веществ уже при растворении могут распадаться.
Исследованиями этих ученых была подготовлена почва для возникновения гипотезы электролитической диссоциации, которую высказал в 1887 году С. Аррениус.
Теория Аррениуса включала следующие основные положения.
1. При растворении молекулы неорганических и органических кислот, оснований и солей диссоциируют на ионы
HCl D H+ + Cl-;
NaOH D Nа+ + OH-;
NaCl D Nа+ + Cl-.
Ионы представляют собой заряженные частицы, которые состоят или из отдельных атомов, или из группы ионов. Предполагалось, что ионы в растворе ведут себя подобно молекулам идеального газа, то есть не взаимодействуют друг с другом. Физические причины ,которые приводят к диссоциации электролитов, в теории Аррениуса не рассматривались.
2. Диссоциация молекул на ионы является неполной, т. е. не все молекулы электролита, а лишь некоторая их доля a, названная степенью диссоциации, распадается на ионы; доля молекул (1 - a) остается недиссоциированной, Таким образом, если при диссоциации одной молекулы электролита образуется n ионов, то концентрация ионов в растворе оказывается равной na∙с ,а концентрация недиссоциированных молекул (1 - a)∙с.
Следовательно, общая молярная концентрация частиц в растворе составит
(1 - a)∙с + na∙с = с[ 1 + a(n - 1)].
Выражение 1 + a (n - 1 ) показывает, во сколько раз увеличивается общая молярная концентрация частиц в растворе за счет диссоциации электролита, т. е. эквивалентно по своему физическому смыслу изотоническому коэффициенту Вант-Гоффа
i = 1 + a (n - 1 ).
3. К процессу электролитической диссоциации применим закон действующих масс.
Так, если в результате диссоциации молекулы электролита МА получаются один катион и один анион
МА = М+ + А- , то
[MA] = c(1 - a) , [M+] = [A-] = c∙a;
К = 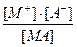 =
= 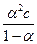 ;
;
a2c + ak - k = 0.
Это уравнение называется законом разведения Оствальда.
По теории Аррениуса константа К является постоянной для данного электролита. Поэтому по этому уравнению можно рассчитать степень диссоциации в зависимости от концентрации электролита
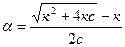 .
.
Как следует из уравнения, при с ® 0 a ® 1 ,т. е. электролит становится полностью диссоциированным.
Теория Аррениуса позволила легко трактовать любые явления, связанные с ионными равновесиями, и легла в основу качественного и количественного анализа.
| <== предыдущая страница | | | следующая страница ==> |
| РАСТВОРЫ ЭЛЕКТРОЛИТОВ | | | ТЕОРИЯ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ ДЕБАЯ И ГЮККЕЛЯ |
Дата добавления: 2014-03-11; просмотров: 364; Нарушение авторских прав

Мы поможем в написании ваших работ!