
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
БИМОЛЕКУЛЯРНЫЙ МЕХАНИЗМ АКТИВАЦИИ МОНОМОЛЕКУЛЯРНОЙ РЕАКЦИИ
Существование мономолекулярных реакций и особенности их протекания ставят перед теорией химической кинетики ряд важных вопросов:
1. Каков механизм активации молекул при мономолекулярном превращении?
Процесс активации путем соударений является процессом в основном бимолекулярным, и скорость любой реакции, активируемой за счет соударений, казалось бы, должна быть прямо пропорциональна квадрату давления (или концентрации). Между тем скорость мономолекулярной реакции пропорциональна первой степени давления (или концентрации). Следовательно, активация при мономолекулярных превращениях осуществляется не в результате соударений, а за счет какого-то другого процесса. Поэтому первые попытки теоретически объяснить мономолекулярные реакции сводились к поискам механизма активации (без учета молекулярных столкновений в реагирующей системе). Было, например, сделано предположение, что активация происходит вследствие поглощения инфракрасного излучения, т. е. является фотохимическим процессом (Перрен). Существовало мнение, что необходимая для активации энергия передается возбужденными продуктами реакции и что протекание мономолекулярных реакций объясняется наличием в системе энергетических цепей (Христиансен и Крамере). Эксперимент не подтвердил этих предположений, и высказывалась даже серьезно мысль о том, что в случае мономолекулярных реакций не выполняется первый закон термодинамики (Томсон).
2. В чем причина перехода кинетики первого порядка в кинетику второго порядка при низких давлениях?
3. Чем объяснить чрезвычайно большие для некоторых реакций (вплоть до 1021) значения предэкспоненциальных множителей?
В 1922 г. Линдеман предложил схему, позволяющую понять механизм мономолекулярных реакций, исходя из представлений о столкновении молекул. Чтобы произошел мономолекулярный процесс распада молекулы А, необходимо, чтобы она обладала колебательной энергией, достаточной для разрыва связей. Эту энергию молекула может накопить в результате соударений, т. е. процесс активации молекулы можно записать в виде
А + А ® А* + А (k1),
где А* — возбужденная молекула.
Одновременно с процессом активации в результате столкновений происходит и дезактивация:
А* + А ® А + А (k2).
В результате этих процессов концентрация активных молекул [А*] поддерживается постоянной, соответствующей максвелл-больцмановскому распределению. Когда реакция не протекает, доля активных молекул не зависит от давления (концентрации), а число их прямо пропорционально давлению (концентрации), поскольку с изменением давления пропорционально изменяются и скорости активации и дезактивации. При наличии химической реакции концентрация активных частиц будет убывать и вследствие их распада:
А* ® Продукты реакции (k3).
При установившемся процессе постоянство концентрации активных молекул будет определяться условием:
скорость активации = скорость дезактивации + скорость реакции, т. е.
k1[А]2 = k2 [А][А*] + k3 [А*] .
Отсюда
[A*] = 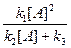 ,
,
а скорость реакции
-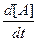 = k3[A*] =
= k3[A*] = 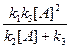 .
.
Активные молекулы А* имеют определенное среднее время жизни tа*, обусловленное вероятностью превращения А* в конечные продукты. В зависимости от соотношения между tа* и временем между столкновениями tст уравнение можно представить в двух предельных формах. При высоких давлениях. столкновения настолько часты (tст << tА* ), что почти все молекулы А* дезактивируются, не успевая прореагировать, т. е.
k2[A] >> k3;
-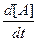 =
=  [A] = k¥[A].
[A] = k¥[A].
Таким образом, этот процесс кинетически является реакцией первого порядка.
С понижением давления время между столкновениями возрастает и может превысить время жизни активной молекулы (tст >> tА*). Тогда большинство молекул, не успевая дезактивироваться, претерпят превращение, т. е.
k3 >> k2[A];
-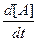 = k1[A]2.
= k1[A]2.
Кинетически это соответствует реакции второго порядка.
Таким образом, теоретическая схема Линдемана дает следующие ответы на вопросы, поставленные перед теорией мономолекулярных реакций.
1. Активация и для мономолекулярных реакций является результатом соударений, т. е. является бимолекулярным процессом. Благодаря тому, что с усложнением строения молекулы время жизни активного комплекса за счет перераспределения энергии столкновения по внутренним степеням свободы молекулы возрастает, скорость реакции оказывается пропорциональной не числу столкновений, а доле активных молекул в реагирующей системе, которая, в свою очередь, прямо пропорциональна общему числу реагирующих молекул. Поэтому выполняется кинетический закон первого порядка.
2. Согласно схеме Линдемана принципиальной разницы между мономолекулярным и бимолекулярным механизмами реакций нет. Все различие между ними состоит в соотношении между временем жизни активного комплекса и промежутком времени между столкновениями. Для двухатомных и трехатомных молекул, у которых вся энергия, полученная при столкновении, сосредоточивается на одной — двух связях, время жизни активного комплекса мало и распад осуществляется еще до того, как молекула успевает дезактивироваться в результате столкновения. Поэтому реагируют все активированные столкновениями молекулы и выполняется кинетическое уравнение второго порядка. Для сложных молекул переход к кинетике второго порядка оказывается возможным лишь при возрастании времени между столкновениями до величин, значительно больших, чем время жизни активного комплекса, что и осуществляется при понижении давления до величины, характерной для каждой данной молекулярной системы.
| <== предыдущая страница | | | следующая страница ==> |
| ПРИМЕНЕНИЕ ТЕОРИИ СТОЛКНОВЕНИЙ К БИМОЛЕКУЛЯРНЫМ РЕАКЦИЯМ. РАСЧЕТ КОНСТАНТЫ СКОРОСТИ | | | ТЕОРИЯ АКТИВНОГО КОМПЛЕКСА ИЛИ ПЕРЕХОДНОГО СОСТОЯНИЯ |
Дата добавления: 2014-03-11; просмотров: 796; Нарушение авторских прав

Мы поможем в написании ваших работ!