
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Физические свойства. Муравьиный альдегид – газ, все остальные оксосоединения – жидкости или твердые вещества
Муравьиный альдегид – газ, все остальные оксосоединения – жидкости или твердые вещества. tкип. альдегидов и кетонов ниже, чем tкип. соответствующих спиртов и карбоновых кислот в связи с отсутствием в молекуле водородных связей. Кетоны – более высококипящие, чем альдегиды. Соединения с разветвленной цепью углеродных атомов имеют более низкие tкип., чем соединения нормального строения. Низшие оксосоединения обладают резким специфическим запахом, с С10 – приятный запах, применяются в парфюмерии. Альдегиды и некоторые кетоны участвуют в формировании вкуса и аромата хлеба, вина и ряда других пищевых продуктов. Все легче воды, многие хорошо в ней растворимы. В чистом виде высокотоксичные, многие – ядовитые вещества.
ХИМИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ
Химические свойства обусловлены наличием карбонильной группы.
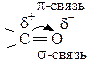
Так как атом кислорода более электроотрицателен, π-связь сильно смещена к нему, на атоме кислорода создается повышенная электронная плотность (проявление нуклеофильных свойств), а на атоме углерода – недостаток (проявление электрофильных свойств). Атом углерода карбонильной группы имеет sp2-гибридизацию, т.е. часть молекулы, содержащая 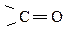 имеет плоское строение, поэтому она является легко доступной для разнообразных реагентов, и оксосоединения являются очень реакционноспособными веществами (альдегиды более реакционноспособны, чем кетоны). С увеличением углеводородного радикала реакционная способность падает:
имеет плоское строение, поэтому она является легко доступной для разнообразных реагентов, и оксосоединения являются очень реакционноспособными веществами (альдегиды более реакционноспособны, чем кетоны). С увеличением углеводородного радикала реакционная способность падает:
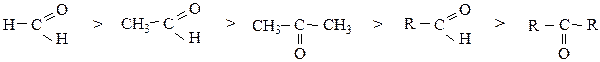
Атом кислорода карбонильной группы оттягивает также электронную плотность с соседнего углерода и атома водорода (в α-положении), поэтому атом водорода может отщепляться в виде протона Н+ (проявление кислотных свойств):
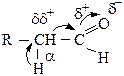
Альдегиды и кетоны вступают в реакции окисления, восстановления, присоединения, замещения, конденсации и полимеризации.
1) Реакции окисления. Альдегиды легко окисляются даже слабыми окислителями:
1.1 реактивом Толленса – “реакция серебряного зеркала”
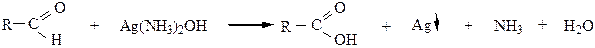
Выпавшее в осадок серебро покрывает стенки пробирки тонким зеркальным слоем. Реакция используется для изготовления елочных игрушек и зеркал и является качественной реакцией на альдегиды.
1.2 реактивом Феллинга (раствор комплексного соединения Cu(OH)2 c сегнетовой солью – калий-натрий-виннокислый):
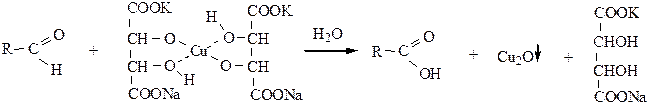
Темно-синяя окраска переходит в красно-кирпичный осадок Cu2O. Реакция качественная на альдегиды, кетоны в этих условиях не окисляются.
1.3 Кетоны окисляются трудно, с разрывом С–С связей, соседних с карбонильной группой (правило Попова-Вагнера) только сильными окислителями (K2Cr2O7 + H2SO4; KMnO4 конц., to) с образованием карбоновых кислот.
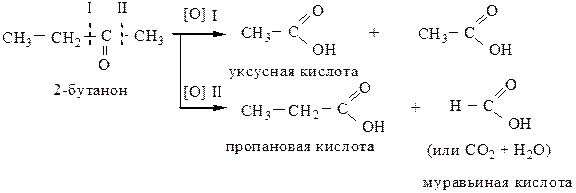
2) Реакции окисления-восстановления характерны только для альдегидов. При этом одна молекула альдегида окисляется, другая – восстанавливается.
2.1 Реакция Канниццаро(для альдегидов, не содержащих водорода в α-положении).
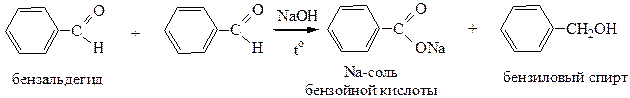
2.2 Реакция Тищенко (для любых альдегидов) – образование сложных эфиров.
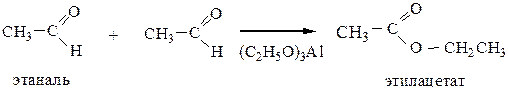
3) Восстановление оксосоединений.
3.1 До спиртов оксосоединения можно восстановить либо водородом в присутствии катализатора (Ni, Pt, Pd), либо LiAlH4. Альдегиды восстанавливаются до первичных спиртов, кетоны – до вторичных:
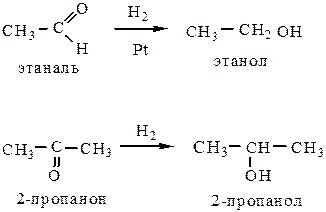
3.2 Восстановление ароматических альдегидов и кетонов (реакция Клеменсена) амальгамированным цинком в НСlконц. происходит до соответствующих аренов.
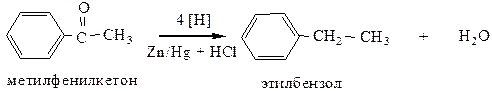
4) Реакции присоединения протекают по нуклеофильному механизму (AN), атом углерода карбонильной группы взаимодействует с нуклеофильным реагентом, двойная связь 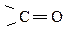 разрывается с образованием аниона, который присоединяет Н+ с получением гидроксисоединения:
разрывается с образованием аниона, который присоединяет Н+ с получением гидроксисоединения:
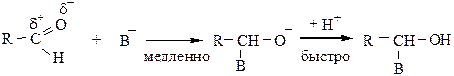
4.1 Присоединение синильной кислоты (HCN) идет в присутствии основания как для альдегидов, так и для кетонов.
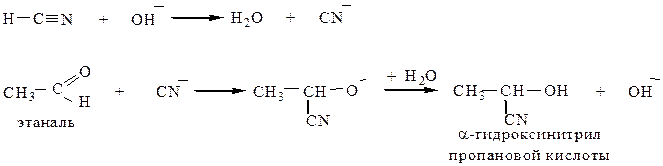 Реакцию применяют для получения нитрилов α-гидрокси- и α-аминокислот.
Реакцию применяют для получения нитрилов α-гидрокси- и α-аминокислот.
4.2 Присоединение гидросульфита натрия (NaHSO3) протекает для альдегидов и метилкетонов 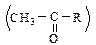 . Если оба радикала кетона больше –СН3, то реакция не идет из-за пространственных затруднений.
. Если оба радикала кетона больше –СН3, то реакция не идет из-за пространственных затруднений.
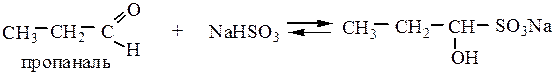
Реакция используется для выделения, очистки и количественного определения карбонильных соединений в веществах, обуславливающих вкус и запах пищевых продуктов, т.к. образующееся гидросульфитное производное выпадает в виде кристаллического осадка. При добавлении кислот или оснований происходит обратная реакция.
4.3 Присоединение спиртов протекает для альдегидов с образованием ацеталей:
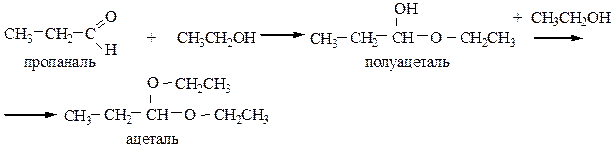
Реакция идет при небольшом нагревании в присутствии HClсух.
Кетоны в этих условиях не присоединяют спирты. Ацетали участвуют в процессах биосинтеза сложных органических соединений, и в формировании запаха ряда пищевых продуктов (например, букета вина).
4.4Присоединение металлорганических соединений:
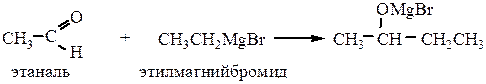
Реакцию используют для получения спиртов (была рассмотрена ранее).
5. Реакции замещения кислорода карбонила. Вначале происходит присоединение реагента к молекуле карбонильного соединения, затем – внутримолекулярная дегидратация:
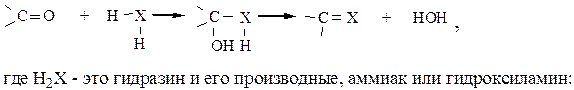
H2N–H, H2N–R, H2N–OH, H2NNH2, H2NNHR и др.
5.1 Действие аммиака на альдегиды приводит к образованию альдиминов, которые затем полимеризуются с образованием альдегидаммиака.
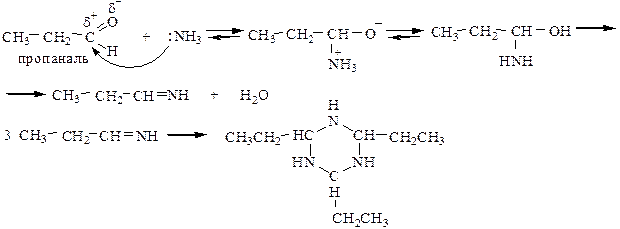
Кетоны в жествких условиях взаимодействуют с NH3 с образованием сложных соединений (в обычных условиях – не взаимодействуют).
5.2 Взаимодействие с гидроксиламином дает альдоксимы и кетоксимы, используемые для идентификации карбонильных соединений:
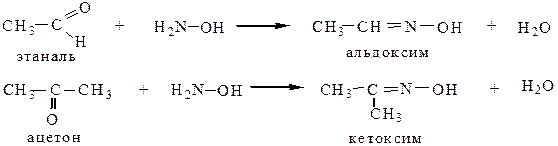
5.3 Взаимодействие с гидразином и его производными приводит к образованию гидразонов, затем азинов:
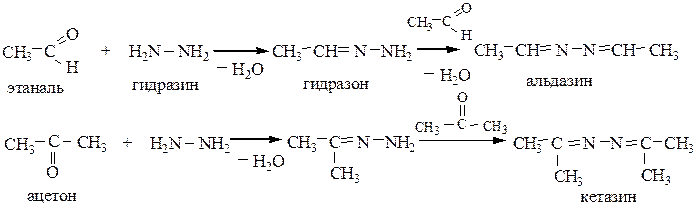
Может быть использован также фенилгидразин (H2NNHC6H5) и его производные.
5.4 Взаимодействие с пентахлоридом фосфора (PCl5) с альдегидами и кетонами приводит к образованию геминальных дигалогенопроизводных:
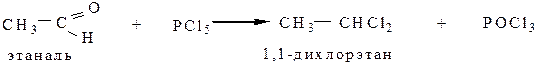
6. Реакции, связанные с подвижностью водорода в α-положении.
Атомы водорода, находящиеся в α-положении к карбонильной группе, обладают большой подвижностью вследствие снижения электронной плотности у углеродного атома карбонильной группы (эффект сопряжения и индукционный эффект отрицательны), поэтому могут легко замещаться.
6.1 Взаимодействие альдегидов и кетонов с галогенами протекает в присутствии оснований с образованием α-галогенопроизводных:
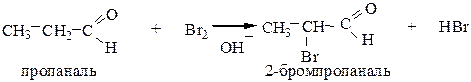
6.2 Реакции конденсации.
1) Альдольная конденсация может быть рассмотрена как нуклеофильное присоединение одной молекулы карбонильного соединения к другой. При этом первая молекула реагирует за счет карбонильной группы (“карбонильная компонента”), вторая – за счет атома водорода в α-положении (“метиленовая компонента”):

Реакция проводится в щелочной среде при 0 оС по следующему механизму:
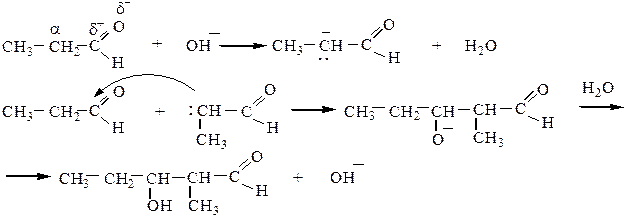
2) Кротоновая конденсация протекает при повышенной температуре через стадию альдольной конденсации с дальнейшим отщеплением воды:
Для протекания кротоновой конденсации метиленовая компонента должна содержать не менее двух атомов водорода в α-положении к карбонилу
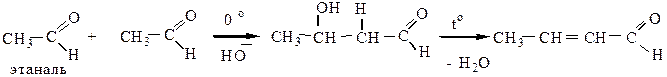
Метиленовая компонента, в данном случае, должна содержать не менее двух атомов водорода в α-положении. Альдольная и кротоновая конденсация протекает как для альдегидов, так и для кетонов.
3) Бензоиновая конденсация протекает при нагревании ароматических альдегидов в присутствии цианидов:

7. Реакции полимеризации характерны только для альдегидов. Формальдегид может образовывать линейный, либо циклический полимер, все остальные – тримеризуются с образованием гомологов 1,3,5-триоксана.
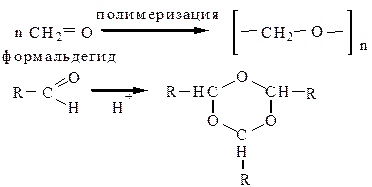
8. Поликонденсация формальдегида с фенолом протекает вначале с образованием фенолоспиртов. Группа –ОН является заместителем I рода, поэтому реакция протекает в о- или п-положение:
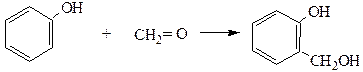
Фенолоспирты при нагревании конденсируются с образованием, в зависимости от условий, различных продуктов (новолачных смол):
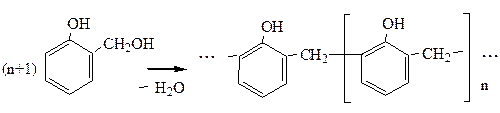
Дата добавления: 2014-04-15; просмотров: 1155; Нарушение авторских прав

Мы поможем в написании ваших работ!