
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лекция № 5 Окислительно-восстановительное титрование (редоксиметрия)
Методы окислительно-восстановительного (ОВ) титрования или red-ox методы – это титриметрические методы, основанные на использовании окислительно-восстановительных реакций.
Теоретические основы реакций окисления-восстановления.
Вещества, атомы или ионы которых отдают электроны-восстановители (процесс-окислением).
Вещества, атомы или ионы которых принимают электроны-окислители (процесс-восстановлением).
Важнейшие окислители: KМnO4, H2O2, Cl2, K2Cr2O7, Br2, KClO3, KBrO3, HNO3, I2 и др.
Важнейшие восстановители: H2S, Na2S2O3, SnCl, HI, HBr, HCl, FeSO4, MnSO4, KI и др.
Каждую окислительно-восстановительную реакцию можно представить как сумму двух полуреакций, одна из которых отражает превращение окислителя, а другая восстановителя:
ок1 + n1e ® восс1 çn2
восс2 – n2е ® ок2 çn1
¾¾¾¾¾¾¾¾¾¾¾¾
n2ок1 + n1восс2 ↔ n2восс1 + n1ок2
ок1 / восс1 ок2 / восс2
Каждая окислительно-восстановительная система количественно характеризуется величиной потенциала: (уравнение Нернста)
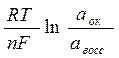 |
Еок/восс = Е0ок/восс +
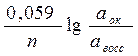 |
Еок/восс = Е0ок/восс +
Е0 стандартный или нормальный окислительно-восстановительный потенциал, В
n – число электронов, принимающих участие в процессе.
Стандартным окислительно-восстановительным потенциалом называют потенциал возникающий на границе раздела благородного Ме и раствора, содержащего окисленную и восстановленную форму, и измеренный относительно стандартного водородного электрода (приводят в справочнике).
Стандартный водородный электрод состоит из платиновой пластинки, выполняющей роль инертного носителя, на которую электролитически наносится слой платиновой черни (платина в мелкодисперсном состоянии). Пластинку погружают в раствор кислоты (HCl или H2SO4) с активной концентрацией Н+, равной 1,0 моль/л. Через данную систему непрерывно пропускают очищенный газообразный водород под давлением. При этом протекает реакция:
Н2 (г) ↔ 2 Н+ + 2 е
Е0 = 0, а уравнение Нернста Е = - 0,059 рН.
Молярная масса эквивалента в реакциях окисления – восстановления
- зависит от числа принимаемых или отдаваемых электронов и рассчитывается по уравнению:
М(fэкв. (Х)Х) = М(Х)/n, где
М(fэкв. (Х)Х) – молярная масса эквивалента,
М(Х) – молярная масса вещества,
N – число электронов, участвующих в процессе.
Д/з: рассчитать молярную массу эквивалента KMnO4 в кислой среде.
Константы равновесия окислительно-восстановительной реакции
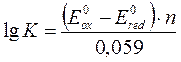 |
где E0ox, E0red – стандартные электродные потенциалы редокс пары,
n – число электронов, участвующих в процессе.
Если lg K = 1 –равновесие
Если lg K > 1 – равновесие смещается в сторону продуктов реакции
Если lg K < 1 – равновесие смещается в сторону исходных веществ.
Классификация методов ОВТ
| Название | Рабочий раствор | Уравнение полуреакции |
| Пермангонато метрия | KМnO4 | 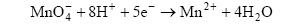 Е0 = 1,51 В
Е0 = 1,51 В
|
| Дихроматометрия | K2Cr2O7 | 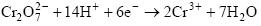 Е0 = 1,33 В
Е0 = 1,33 В
|
| Йодометрия | I2 | I2 + 2 e- ® 2I- Е0 = 0,55 В |
| Броматометрия | KBrO3 | BrO3- + 6e- + 6H+®Br - + 3H2O Е0 = 1,45 В |
| Церийметрия | CeO2, Ce(NO3)×NH4NO3, Ce(SO4)2×NH4NO3 | Ce4+ + 1e-®Ce3+ Е0 Ce4+/Ce3+ =1,74 В |
Способы фиксирования точки эквивалентности в методах окислительно-восстановительного титрования
| Индикаторный | Безиндикаторный | |
| Специфические индикаторы | Редокс-индикаторы | Проводят при работе с окрашенными титрантами, которые окисляясь или восстанавливаясь, обесцвечиваются |
| Образуют окрашенные соединения с определяемым веществом или титрантом. Точку эквивалентности фиксируют по исчезновению или появлению окраски. (крахмал в йодометрии) | Вещества, изменяющие окраску в зависимости от потенциала системы Фенилантраниловая кислота, дифенилбензидин, ферроин, дифениламин и др. | Перманганатометрия (конец титрования определяют по неисчезающему бледно-малиновому окрашиванию раствора от одной избыточной капли добавленного титранта) |
| <== предыдущая страница | | | следующая страница ==> |
| Методы комплексонометрического титрования | | | Перманганатометрия |
Дата добавления: 2014-04-30; просмотров: 699; Нарушение авторских прав

Мы поможем в написании ваших работ!