
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Цветные металлы и сплавы
Коррозия - это процесс разрушения металла под воздействием внешней среды. Установлено, что в результате коррозии ежегодно безвозвратно теряется около 10 % всех производимых металлов. Эти потери происходят как в процессе производства заготовок при прокате, ковке, штамповке, так и в процессе эксплуатации конструкций.
Особенно велики потери металла и убытки от коррозионного разрушения пролетных строений мостов, железнодорожного пути, контактной сети, подвижного состава, металлических конструкций зданий (крыш, каркасов). Их замена сопряжена с большими трудностями, а в ряде случаев - с остановкой движения поездов или с временным прекращением производственных процессов. Поэтому борьба с коррозией является очень важной государственной задачей.
Все распространенные металлы встречаются в природе в виде соединений с кислородом и другими элементами: железо — в виде Ре2Оэ, Ре304, РеС03, алюминий - в виде А1203, медь - в виде СиРе82, Си28 и т. д. При выплавке металлов имевшиеся в природных условиях связи нарушаются, а во время коррозии вновь восстанавливаются - образуются те же соединения, например железа и алюминия с кислородом, меди с серой и т. д. В этом и заключается причина возникновения коррозии.
Различают следующие виды коррозии: сплошную (рис. 23, а), если коррозия распространяется на всю поверхность изделия; местную (рис. 23, б), когда коррозионное разрушение происходит на отдельных участках поверхности; межкристаллитную (рис. 23, в), протекающую по границам зерен, в результате которой ухудшаются механические свойства металлов
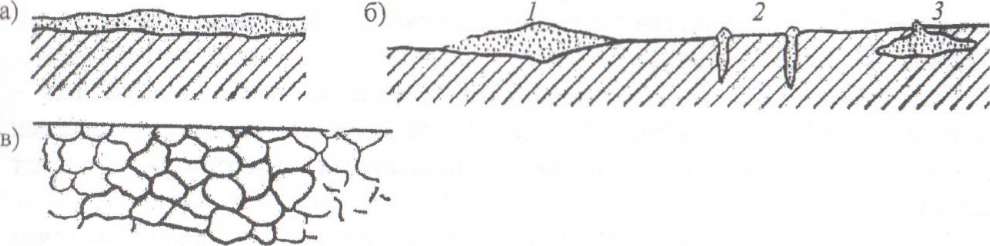 Рис. 23. Виды коррозии (разрез): а) сплошная; б) местная (1 - пятнами; 2 - точечная; 3 - подповерхностная);
в) межкристаллитная
Рис. 23. Виды коррозии (разрез): а) сплошная; б) местная (1 - пятнами; 2 - точечная; 3 - подповерхностная);
в) межкристаллитная
|
В зависимости от характера протекающих физико-химических процессов различают два вида коррозии - химическую и электрохимическую.
Химическая коррозия - это разрушение, которое протекает при нахождении металла в сухих газах при повышенной температуре (газовая коррозия) и в неэлектролитах (бензине, сернистой нефти, расплавах солей). Суть газовой коррозии состоит в образовании на поверхности металла тонкой пленки окислов и в диффузии газов через эти пленки. При повышении температуры, например при нагреве заготовок под ковку, диффузионные процессы усиливаются и химическая коррозия протекает с образованием окалины - толстого слоя окислов. Коррозия в неэлектролитах также сопровождается образованием пленки. В некоторых случаях эта пленка может защищать лежащий под ней металл от дальнейшей коррозии. Сравнительно плотные пленки оксидов образуются на поверхности алюминия, свинца, олова, никеля, хрома.
Наиболее распространенным видом разрушения металлов является электрохимическая коррозия - разрушение под воздействием водных растворов электролитов — солей, кислот, щелочей. К этому виду коррозии относят и атмосферную коррозию, при которой влага из воздуха конденсируется на поверхности металла, а в ней растворяются агрессивные газы. Наличие на поверхности металла пыли и других загрязнений усиливает адсорбцию влаги и газов, а влажная пленка на поверхности представляет собой электролит.
Электрохимическая коррозия протекает следующим образом. Металлы и сплавы всегда являются химически и физически неоднородными. Компоненты сплава, различные фазы структуры, чистый металл и окисная пленка, два соседних участка с разной напряженностью образуют комплекс анодных и катодных участков, представляющих собой микроскопические гальванические пары, это приводит к тому, что на границе «металл - электролит» происходит растворение анодных участков. Таким образом, электрохимическая коррозия — это разрушение сплава, сопровождающееся появлением электрического тока в результате работы множества микрогальванических элементов на корродирующей поверхности металла.
Структура стали в равновесном состоянии состоит из двух фаз - феррита и цементита. При электрохимической коррозии цементит остается неизменным, а феррит растворяется и с веществом электролита образует ржавчину.
В гальванической паре разрушается тот металл, который выделяет большее количество положительно заряженных ионов и, следовательно, сам получает высокий отрицательный заряд. Если металлы расположить в следующий ряд: Аи, Р1, А§, Си, Вц БЬ, РЬ, Бп, Со, Ее, Сг, Ъх\, Мл, П, А1, М|>, то окажется, что всякий металл, расположенный правее, будет разрушаться в контакте с металлом, расположенным левее, и тем сильнее, чем дальше эти металлы находятся друг от друга в ряду. Так, в паре «железо - цинк» будет разрушаться цинк, а в паре «железо - никель» разрушаться будет железо.
На скорость растворения металла в электролите влияют примеси, способы обработки металла, концентрация электролитов. Металл, находящийся под нагрузкой, корродирует значительно быстрее нанагруженного, так как
нарушается целостность защитной пленки и образуются микротрещины (коррозионное растрескивание). Разрушение металла одновременным воздействием знакопеременных нагрузок и коррозионной среды называют коррозионной усталостью.
В зависимости от характера окружающей среды электрохимическая коррозия может быть подводной, атмосферной, почвенной, вызванной блуждающими токами. Электрохимическая коррозия металлов в воде обусловливается присутствием в ней растворенного кислорода. При атмосферной коррозии электролитом служит тонкая пленка влаги, сам же процесс ничем не отличается от коррозии в воде.
В результате коррозии стали на ее поверхности появляется смесь различных гидратированных оксидов железа, имеющих состав пРеО • рН20 + + тРе20з • цН20 (ржавчина).
Активному протеканию процесса коррозии способствуют углекислый и в особенности сернистый газ, хлористый водород, различные соли.
Защиту от коррозии следует начинать с правильного подбора химического состава и структуры металла. При конструировании необходимо избегать форм, способствующих задержке влаги.
Для защиты металла от коррозии применяют различные способы. Легирование стали повышает ее антикоррозионные свойства. Например, совершенную стойкость к атмосферной коррозии показывают нержавеющие легированные стали, содержащие в большом количестве хром (более 12 %), который, образуя на поверхности оксидные пленки, приводит сталь в пассивное состояние (хромистые стали марок 08X13).
Стойкость к коррозии хромистых сталей повышается при введении в их состав никеля. Поэтому различают нержавеющие стали хромистые и никелевые. Например, хромистые стали марок 08X13, 12X17, 15Х25Т хорошо свариваются, пластичны и потому широко используются в промышленности, технологичны и хромоникелевые сплавы марок 17Х18Н9, 12Х18Н10Ти др.
Существенно (в 1.5...3 раза) повышается коррозионная стойкость строительных сталей при введении в их состав меди (0,2...0,5 %). Повышенной стойкости нержавеющих сталей против коррозии способствуют также их однородность и небольшое содержание вредных примесей.
Для защиты металла от коррозии на его поверхности создают пленочные покрытия:
• металлические (анодное или катодное) путем оксидирования, фосфатирования, плакирования или металлизации;
• лакокрасочные.
Для анодного покрытия используют металлы, обладающие большим отрицательным электродным потенциалом, чем основной металл (например, цинк, хром). Для катодного покрытия выбирают металлы, имеющие меньшее отрицательное значение электродного потенциала, чем основной металл (медь, олово, свинец, никель и др.). Металлические покрытия наносят горячим методом, гальваническим и металлизацией.
При горячем методе покрытия изделия погружают в ванну с расплавленным защитным металлом (цинк, олово, свинец), с соответствующей температурой плавления изделия.
Гальванический метод защиты состоит в том, что на поверхности изделия путем электролитического осаждения из растворов солей образуется тонкий слой защищаемого металла. Покрываемое изделие при этом служит катодом, а осаждаемый металл - анодом.
Металлизация - покрытие поверхности детали расплавленным металлом, распыленным при помощи сжатого воздуха. Преимуществом этого метода защиты металла является то, что покрывать расплавом можно уже собранные конструкции. Недостаток заключается в том, что поверхность получается шероховатой.
Металлические покрытия можно наносить также посредством диффузии металла покрытия в основной металл (алитирование, силицирова- ние, хромирование), а также способом плакирования, т. е. наложения на основной металл тонкого слоя защитного металла (биметалл) и закрепления его путем горячей прокатки (например, железо - медный сплав, дюралюминий - чистый алюминий).
Оксидирование — защита оксидными пленками. Для этого естественную оксидную пленку, всегда имеющуюся на металле, делают более прочной путем обработки сильным окислителем, например концентрированной азотной кислотой, растворами марганцевой или хромовой кислот и их солей. Частным случаем оксидирования является воронение стали. В этом случае на поверхности также создается оксидная пленка, но более сложными приемами, связанными с многократной термической обработкой при температуре 300.. .400 °С с использованием древесного угля.
Фосфатирование состоит в получении на изделии поверхностной пленки из нерастворимых солей железа или марганца в результате погружения металла в горячие растворы кислых фосфатов железа или марганца.
Лакокрасочные покрытия (пленка из различных красок и лаков) способствуют механической защите металла. К примеру, ванны, раковины, декоративные изделия для защиты от коррозии покрывают эмалью, т. е.
наплавляют на металл при температуре 750...800 °С различные комбинации силикатов.
Для временной защиты металлических изделий от коррозии (при транспортировании, складировании) для покрытия металла используют невысыхающие масла (технический вазелин, лак этиноль), а также ингибиторы, т. е. вещества, замедляющие реакции (нитрит натрия с углекислым аммонием, с уротропином, ингибиторную бумагу и др.).
Для защиты от коррозии подводных частей кораблей и гидросамолетов применяют протекторную защиту металлов. Суть метода состоит в следующем: к защищаемому изделию прикрепляют металлические пластины, которые в гальванической паре являются анодами. Анод разрушается, а катод - основной металл конструкции - сохраняется. Такой метод защиты называется протекторным.
Библиографический список
1. ГОСТ 19281-89. Прокат из стали повышенной прочности. Общие технические условия. - [Б. г.: б. и.], 2009.
2. ГОСТ 6713-91 Прокат низколегированный конструкционный для мостостроения. Технические условия. — [Б. г.: б. и.], 1992.
3. ГОСТ 10884-94. Сталь арматурная термомеханически упрочненная для железобетонных конструкций. — [Б. г.: б. и.], 1985.
4. СНиП 2.05.03-84.Строительные нормы и правила. Мосты и трубы.-М. : Стройиздат, 1985.
5. Арзамасов В. Б. Материаловедение и технология конструкционных материалов: учебник для вузов / В. Б. Арзамасов, А. Н. Волочков, А. А. Черепа- хин. - М : Академия, 2007. - 448 с.
6. Горчаков Г. И. Строительные материалы: учебник для вузов / Г. И. Горчаков, Ю. М. Баженов. — М. : Стройиздат, 1986. - 688 с.
7.Домокеев А. Г. Строительные материалы: учебник для вузов / А. Г. До- мокеев. — М.: Высшая школа, 1989. — 485 с.
8. Комохов П. Г. Арматурные стали для железобетонных конструкций: учеб. пособие / П. Г. Комохов, Ю. А. Беленцов. - СПб, : Петербургский гос. ун-т путей сообщения, 2008. - 39 с.
9. Комохов П. Г. Конструкционные сплавы, стали и чугуны: учеб. пособие / П. Г. Комохов, Т. М. Петрова, Н. Н. Шангина. - СПб. : Петербургский гос. ун-т путей сообщения, 2005. - 58 с. 1
10. Лахтин Ю. М. Сеталловедение и термическая обработка металлов: учебник для вузов. - М. : Металлургия, 1983. - 360 с.
11.Мадатян С. А. Арматура железобетонных конструкций / С. А. Мада- тян. - М.: ООО «Воентехлит», 2000.
12. Мамлин Г. А. Производство конструкций стальных мостов / Г. А. Мамлин. -М. : Транспорт, 1994.
13. Фетисов Г. П. Материаловедение и технология металлов: учебник для вузов / Г. П, Фетисов, М. Г. Карпман, В. М. Митюнин. - М. : Высшая школа, 2008. - 877 е.; илл.
14. Яковлева Т. Г. Железнодорожный путь / Т. Г. Яковлева. - М. : Транспорт, 1999.
Содержание
Введение.................................................................................................................... 3
1. Классификация металлов и сплавов............................................................. 4
2. Основы строения металлов и сплавов.......................................................... 5
2.1.Кристаллическое строение металлов................................................. .—
2.2.Строение металлических сплавов........................................................ 10
2.3. Диаграмма состояния двойных сплавов 12
2.4.Методы механических испытаний металлов и сплавов................. 19
3. Сплавы на основе железа.............................................................................. 23
3.1.Основы технологии производства стали и чугуна.............................. -
3.2.Обработка металла давлением.............................................................. 28
3.3. Диаграмма состояния железнодорожных сплавов 33
3.4. Углеродистые стали 38
3.4.1. Классификация углеродистых сталей -
3.4.2. Основы термической обработки стали 44
3.5. Легированные стали 52
3.6. Чугуны 58
4. Применение стали в различных областях строительства.................... 61
4.1. Виды сталей, используемых в строительстве -
4.2.Стали, применяемые в мостостроении................................................ 64
4.3.Стали для верхнего строения пути....................................................... 66
4.4. Арматурные стали для железобетонных конструкций 69
5. Коррозия металлов и методы защиты от нее........................................... 75
Библиографический список 80
Учебное издание
Петрова Татьяна Михайловна, Попова Ольга Сергеевна
МЕТАЛЛЫ И СПЛАВЫ В СТРОИТЕЛЬСТВЕ
Учебное пособие
Редактор и корректор И. А. Шабранская Компьютерная верстка Л. А. Каратановой
План 2009 г., № 33 Подписано в печать с оригинал-макета 12.03.2010. Формат 60x84 1/16. Бумага для множ. апп. Печать офсетная. Усл. печ. л. 5,2. Тираж 300 экз. Заказ 253.
Петербургский государственный университет путей сообщения. 190031, СПб., Московский пр., 9. Типография ПГУПС. 190031, СПб., Московский пр., 9
Цветные металлы и сплавы.
Цель:
1. Сформировать навыки расшифровки сплавов.
2. Развитие аналитического, синтезирующего и абстрактного мышления, умений применять знания на практике.
3. Развитие умений учебного труда, инициативы, уверенности в своих силах.
4. Развитие умений действовать самостоятельно
Оборудование: Учебная и справочная литература, сайт www.splav.kharkov.com
Задание 1: Медь и ее сплавы
Изучить марки меди и их свойства.
| Марка меди | Содержание Сu в процентах | Содержание кислорода в процентах | Предел прочности МПа | Предел текучести МПа | Пластичность % |
| М0 | 99.93 | 0.03 | 200-250 400-490 | 90-150 300-450 | |
| М0б | 99.97 | 0.001 | 200-250 400-490 | 90-150 300-450 | |
| М00 | 99.96 | 0.03 | 200-250 400-490 | 90-150 300-450 | |
| М00б | 99.99 | 0.01 | 200-250 400-490 | 90-150 300-450 | |
| М3р | 99.5 | 0.01 | 200-250 400-490 | 90-150 300-450 |
Латунь, марки, назначение.
| Марка | Содержание меди % | Содержание Элементов % | Предел Прочности МПа | Предел Текучести МПа | Пластичность % |
| ЛС 59-1 | |||||
| Л90 | |||||
| Л60 | |||||
| ЛАН59-3-2 | |||||
| ЛЦ14К3С3 |
Бронзы, марки, назначение.
| Марки | Содержание меди % | Содержание Элементов % | Предел Прочности МПа | Предел Текучести Мпа | Пластичность % |
| БрБ2 | |||||
| БрОС4-3 | |||||
| БрО8Ц4 | |||||
| БрАЖМц10-3-1.5 | |||||
| БрОФ6.5-0.4 |
Задание 2: Алюминий и сплавы на основе алюминия.
| Марки | Содержание алюминия % | Содержание Элементов % | Предел Прочности МПа | Предел Текучести Мпа | Пластичность % |
| АД33 | |||||
| В95 | |||||
| Д16 | |||||
| АЛ24 | |||||
| АК5М2 |
Задание 3:Выбрать на сайте splav.kharkov.com две марки криогенной стали. Привести химический состав, механические свойства и назначение сталей.
Содержание отчета.
1. Тема
2. Цель
3. Задание №1
4. Задание №2
5. Задание №3
6. Выводы по работе.
Литература
1. Сайт www.splav.kharkov.com
2. Лахтин Ю.М. Основы металловедения. М: Металлургия, 1988
3. Колесов С.Н. Материаловедение и технология конструкционных материалов: Учеб. Для вузов-М.: Высшая школа,2004г.-519с.:ил.
4. Электротехнические и конструкционные материалы : Справочник, М.: Академия, 2000.
| <== предыдущая страница | | | следующая страница ==> |
| Коррозия металлов и методы защиты от нее | | | Цены на стандартные купольные конструкции потолка. 1. Сформировать навыки расшифровки сплавов |
Дата добавления: 2014-07-14; просмотров: 598; Нарушение авторских прав

Мы поможем в написании ваших работ!