
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Примеры. 1. Записать математическое выражение закона действующих масс для гомогенной реакции
1. Записать математическое выражение закона действующих масс для гомогенной реакции:
2NO(г) + O2(г) = 2NO2(г).
Решение:
V = k·СNO2·СO2 или V = k·РNO2·РO2.
2. Как изменится скорость химической реакции:
2NO(г) + Сl2(г) = 2NOCl(г),
если концентрацию первого реагирующего вещества увеличить в 3 раза?
Решение: до изменения условий скорость данной химической реакции выражалась уравнением
V = k · СNO2·СCl 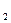 .
.
Концентрации веществ и скорость химической реакции при изменении условий выделим штрихом ( ' ). При изменении условий: С'NO = 3· СNO, тогда
V' = k ·(С'NO)2· СCl 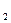 = k ·(3· СNO)2· СCl
= k ·(3· СNO)2· СCl 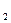 = 9· k · СNO2· СCl
= 9· k · СNO2· СCl 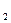 .
.
Найдем, во сколько раз изменилась скорость химической реакции при увеличении концентрации первого реагирующего вещества в 3 раза:
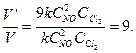
Ответ: скорость химической реакции увеличится в 9 раз.
3. Как изменится скорость химической реакции:
2S(тв.) + 3О2(г.) = 2SO3(г.),
если давление в системе уменьшить в 2 раза?
Решение: до изменения условий (уменьшение давления) скорость данной гетерогенной химической реакции выражалась уравнением
V = k · (СO 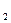 )3 = k · (РO
)3 = k · (РO 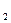 )3.
)3.
После уменьшения давления в системе в 2 раза парциальное давление кислорода, как и его молярная концентрация, также уменьшается в 2 раза: Р'O 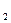 = 1/2 РO
= 1/2 РO 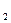 , тогда
, тогда
V' = k · (Р'O 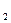 )3 = k ·(1/2РO
)3 = k ·(1/2РO 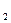 )3 = 1/8 k ·(РO
)3 = 1/8 k ·(РO 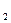 )3;
)3;
отсюда
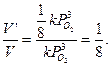
Ответ: скорость химической реакции уменьшится в 8 раз.
| <== предыдущая страница | | | следующая страница ==> |
| Закон действующих масс. Зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действующих масс | | | Зависимость скорости химической реакции от температуры |
Дата добавления: 2014-09-29; просмотров: 358; Нарушение авторских прав

Мы поможем в написании ваших работ!