
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Исходные вещества Активированный комплекс Продукты реакции
Для образования активного комплекса нужно преодолеть некоторый энергетический барьер, затратив энергию ЕА. Эта энергия и есть энергия активации – некоторая избыточная энергия, по сравнению со средней при данной температуре энергией, которой должны обладать молекулы для того, чтобы их столкновения были эффективными.
В общем случае для химической реакции А + В = С +Д переход от исходных веществ А и В к продуктам реакции С и Д через состояние активного комплекса А + В = А¼В = С + D схематически можно представить в виде энергетических диаграмм (рис. 6.2).
  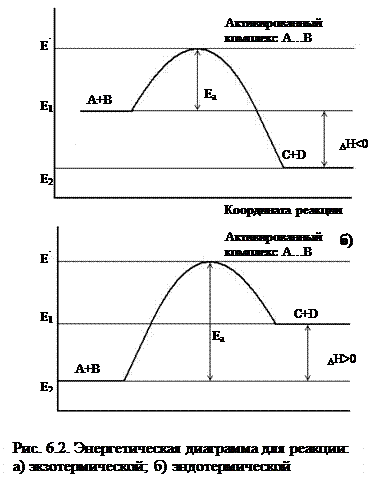 |
Энергия активации ЕА – один из основных параметров, который характеризует скорость химического взаимодействия. Она зависит от природы реагирующих веществ. Чем больше ЕА, тем меньше (при прочих равных условиях) скорость реакции.
Обычно реакции между веществами с прочными ковалентными связями характеризуются большими значениями ЕА и идут медленно, например:
| а) взаимодействия между органическими веществами | Скорость этих процессов при стандартных условиях близка к нулю |
| б) H2 + 1/2О2 = H2О | |
| в) N2 + 3H2 = 2NH3 |
Низкими значениями ЕА и очень большими скоростями характеризуются ионные взаимодействия в растворах электролитов. Например:
Ca+2 + SO 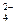 = CaSO4.
= CaSO4.
Объясняется это тем, что разноименно заряженные ионы притягиваются друг к другу и не требуется затрат энергии на преодоление сил отталкивания взаимодействующих частиц.
| <== предыдущая страница | | | следующая страница ==> |
| Зависимость скорости химической реакции от температуры | | | Влияние катализатора |
Дата добавления: 2014-09-29; просмотров: 383; Нарушение авторских прав

Мы поможем в написании ваших работ!