
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Дихроматометрическое титрование
Дихроматометрическое титрование - титриметрический метод анализа, основанный на применении в качестве титранта K2Cr2O7.
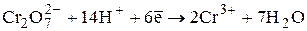 E0 = +1,33 В
E0 = +1,33 В
Стандартный раствор K2Cr2O7 является первичным. Он устойчив при хранении. В отличие от KMnO4 дихромат не восстанавливается следами органических веществ и хлорид-ионов, содержащихся в воде. Для обнаружения конечной точки титрования обычно используют окислительно-восстановительные индикаторы: дифениламин, ферроин и др.
Дихроматометрическое титрование применяют для определения восстановителей, некоторых окислителей, а также ионов, образующих малорастворимые в воде хроматы или дихроматы. Как и перманганатометрическое титрование дихроматометрия используется, главным образом, для определения неорганических веществ и сравнительно редко используется в фармацевтическом анализе.
Прямое дихроматометрическое титрование заключается в том, что раствор определяемого восстановителя подкисляют серной кислотой и титруют стандартным раствором K2Cr2O7, например:
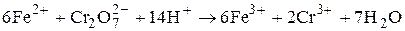
Если реакция окисления протекает медленно, используют обратное титрование. Раствор определяемого вещества кипятят с избытком стандартного раствора K2Cr2O7, а затем избыток титранта, не вступивший в реакцию, титруют стандартным раствором Fe2+ (соли Мора). Подобное дихроматометрическое титрование используется, например, при определении «химического потребления кислорода» (ХПК) - величины, характеризующей содержание органических веществ в воде. Химическим потреблением кислорода называют массу кислорода (мг) или окислителя в расчёте на кислород, необходимого для полного окисления, содержащихся в 1л данного образца воды органических веществ. ХПК имеет размерность мг/л. Для определения ХПК к пробе воды добавляют необходимое количество HgSO4 (для связывания хлорид-ионов, которые также могут окисляться дихроматом калия), H2SO4, Ag2SO4 (катализатор) и взятое в заведомом избытке точное количество стандартного раствора K2Cr2O7. Полученную смесь кипятят с обратным холодильником в течение 2-х часов. Затем раствор разбавляют водой и титруют непрореагировавший дихромат калия стандартным раствором Fe2+.
Дихроматометрическое титрование может быть использовано для определения некоторых необратимо восстанавливающихся окислителей, например, нитратов или хлоратов. К раствору, содержащему определяемое вещество, добавляется избыток стандартного раствора Fe2+. После проведения реакции оставшееся количество Fe2+ титруют стандартным раствором K2Cr2O7.
Дихроматометрическое титрование используется также как осадительное титрование для определения веществ, образующих малорастворимые в воде хроматы или дихроматы. К раствору, содержащему определяемый катион, добавляют избыток стандартного раствора дихромата калия. Выпавший осадок отфильтровывают, а в фильтрате определяют оставшееся количество K2Cr2O7 путём титрования стандартным раствором Fe2+ или иодометрически. Такой вариант титрования используется, например, для определения метиленового синего.
| <== предыдущая страница | | | следующая страница ==> |
| Перманганатометрическое титрование | | | Цериметрическое титрование |
Дата добавления: 2014-10-10; просмотров: 695; Нарушение авторских прав

Мы поможем в написании ваших работ!