
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Общая характеристика. Комплексометрическое титрование – группа титриметрических методов анализа, основанных на реакциях образования растворимых комплексных соединений
Комплексометрическое титрование – группа титриметрических методов анализа, основанных на реакциях образования растворимых комплексных соединений.
К реакциям, применяемым в комплексометрическом титровании, предъявляются такие же требования, что и к реакциям, используемым в других титриметрических методах анализа:
· большая константа равновесия,
· стехиометричность,
· протекание с приемлемой скоростью при обычных условиях,
· возможность обнаружения конечной точки титрования.
Из всех реакций комплексообразования ионов металлов с монодентатными лигандами всего лишь несколько подходят для титриметрии. К ним относятся реакции образования галогенидных и некоторых других комплексов ртути (II), положенные в основу меркуриметрического титрования; цианидных (цианидометрия) и фторидных (фторидометрия) комплексов ряда металлов. При взаимодействии с монодентатными лигандами ионы металлов образуют не один, а несколько комплексов. Для появления скачка титрования необходимо, чтобы устойчивость одного из образующихся комплексов заметно отличалась от устойчивости других. Например, комплекс HgCl2 заметно более устойчив, чем комплексы, образующиеся при его дальнейшем взаимодействии с Cl- (lgK1 = 6,74; lgK2 = 6,48; lgK3 = 0,95; lgK4 = 1,05), вследствие чего этот комплекс будет доминировать в растворе в широком интервале концентраций лиганда.
Полидентатные хелатообразующие лиганды, как правило, взаимодействуют с катионами металлов с образованием единственного комплекса с соотношением компонентов 1:1. Кроме того, вследствие хелатного эффекта комплексы катионов металлов с такими лигандами более устойчивы, чем комплексы с аналогичными монодентатными лигандами.
15.2. Меркуриметрическое титрование
Меркуриметрическое титрование – титриметрический метод анализа, основанный на образовании растворимых комплексных соединений ртути (II).
Основная область применения меркуриметрического титрования - определение галогенид-ионов.
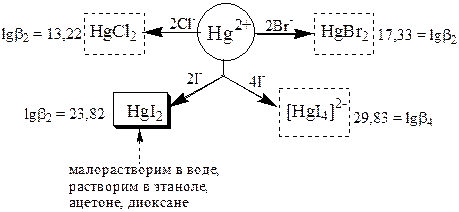
В качестве титранта в меркуриметрическом титровании используют Hg(NO3)2. Стандартный раствор этого вещества является вторичным. Исходным веществом для его приготовления служит Hg(NO3)2×H2O. Данное вещество плохо растворимо в воде, поэтому его растворяют в небольшом количестве азотной кислоты. После того как соль растворится, раствор разбавляют водой до нужного объёма. Для стандартизации используют NaCl или стандартный раствор NH4SCN.
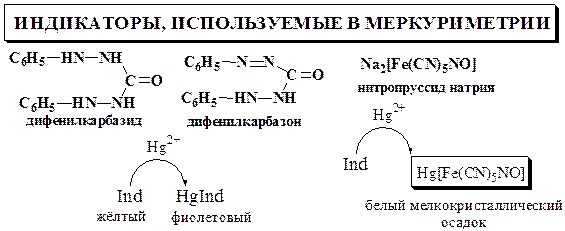
Дифенилкарбазон представляет собой слабую кислоту, поэтому его взаимодействие с ионами Hg2+ зависит от рН.
В случае титрования хлоридов pHопт = 1,5 – 2 (верхний предел может быть расширен до 4). В более кислой среде чувствительность индикатора уменьшается, и определяемое вещество будет перетитровано. При увеличении рН индикатор, наоборот, начинает образовывать с Hg2+ окрашенное соединение до точки эквивалентности, вследствие чего определяемое вещество оказывается недотитрованным.
Для создания оптимального значения рН к титруемому раствору прибавляют азотную кислоту, как правило, до концентрации 0,02 – 0,04 моль/л. При обнаружении конечной точки титрования с помощью дифенилкарбазида титрование проводят в слабокислой или нейтральной среде.
Нитропруссид натрия можно использовать для обнаружения конечной точки титрования сильнокислых растворов.
Меркуриметрическое определение иодид-ионов может быть основано либо на реакции u, либо на реакции v.

Меркуриметрия является альтернативным (по отношению к аргентометрии) методом определения галогенидов и достаточно широко используется в фармацевтическом анализе, в особенности при контроле качества лекарственных средств непосредственно в аптеках. Этот метод, во-первых, более дешёвый, а, во-вторых, позволяет использовать прямое титрование для анализа кислых растворов. Основной его недостаток заключается в токсичности титранта.
| <== предыдущая страница | | | следующая страница ==> |
| Титрование в основных растворителях | | | Комплексонометрическое титрование |
Дата добавления: 2014-10-10; просмотров: 585; Нарушение авторских прав

Мы поможем в написании ваших работ!