
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ОТ КОРРОЗИИ
Коррозией называют самопроизвольное разрушение металлов и сплавов вследствие физико–химического взаимодействия их с окружающей средой.
По механизму протекания процесса различают коррозию химическую и электрохимическую.
Химическая коррозия протекает в неэлектропроводных средах (сухая атмосфера воздуха, растворы неэлектролитов). Химическая коррозия представляет собой непосредственное взаимодействие металла с окислителем, то есть процессы окисления и восстановления протекают одновременно и на одном и том же участке поверхности:
4Fe + 3O2 = 2Fe2О3
2  2Fe – 6e
2Fe – 6e  2Fе3+ (окисление)
2Fе3+ (окисление)
3 O2 + 4е  2O2- (восстановление)
2O2- (восстановление)
Электрохимическая коррозия протекает в электропроводных средах: растворы электролитов, влажная атмосфера воздуха (относительная влажность воздуха больше 65%).
Наличие электропроводной среды делает возможной работу большого числа небольших по размеру гальванических элементов (микрогальванопар). Причиной образования на поверхности металла гальванических элементов является то, что большинство технически важных металлов имеют в своем составе примеси или даже специально вводимые добавки. Поэтому отдельные участки поверхности металла имеют более положительное, другие – более отрицательное значение потенциала (электрохимическая неоднородность поверхности).
Основной причиной коррозии является термодинамическая неустойчивость металла или сплава в той или иной коррозионной среде. Критерием термодинамической вероятности коррозии является уменьшение изобарно - изотермического потенциала ( 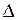 G < 0). В электрохимических процессах изменение изобарно - изотермического потенциала определяется по формуле
G < 0). В электрохимических процессах изменение изобарно - изотермического потенциала определяется по формуле
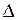 G = –nF
G = –nF 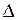 E ,
E ,
где: n - число электронов, принимающих участие в реакции;
F - число Фарадея;
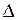 Е - разность потенциалов, при которых протекают катодные и анодные процессы (
Е - разность потенциалов, при которых протекают катодные и анодные процессы ( 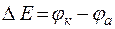 ).
).
Если 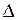 Е > 0, т.е.
Е > 0, т.е. 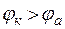 , то ∆G < 0, и процесс коррозии протекает самопроизвольно.
, то ∆G < 0, и процесс коррозии протекает самопроизвольно.
Приближенная оценка степени термодинамической нестабильности различных металлов в наиболее распространенных коррозионных средах может быть сделана по величине стандартных электродных потенциалов (см. таблицу «Стандартные электродные потенциалы металлов» Приложения), что примерно соответствует потенциалу окисления металла в анодном процессе Еа.
Наиболее распространенными коррозионными средами являются водные растворы электролитов, содержащие в качестве окислителя растворенный кислород или ионы водорода, то есть чаще всего коррозионный процесс протекает с кислородной или водородной деполяризацией. Величины потенциалов, соответствующих катодному процессу ЕК в наиболее распространенных коррозионных средах, представлены в таблице 1, в которой выделены 4 группы металлов, термодинамически неустойчивых в той или иной среде (∆G <0, если ЕК>ЕА).
Особое место среди металлов занимает золото (ЕОAu/Au3+ = + 1,5В), которое является термодинамически устойчивым во всех наиболее распространенных коррозионных средах, указанных в таблице 1.
Таблица 1. Классификация металлов по термодинамической неустойчивости в различных средах
| Коррозионные среды | Катодный процесс (кислородная или водородная деполяризация) | Еок, в | Группы металлов, для которых ∆G <0 | Потенциалы анодов*, ЕоА, В (ЕоМе / Ме п+ ) |
| Нейтральная среда в отсутствии растворенного кислорода | 2Н2О +2е = Н2 +2ОН– | -0,413 | I Li…Fe | -3,01<E< -0,413 |
| Кислая среда в отсутствии растворенного кислорода | 2Н+ +2е =Н2 | 0,00 | II Li…W | -3,01<E< 0,00 |
| Нейтральная среда в присутствии растворенного кислорода и влажная атмосфера | О2+2Н2О +4е = 4ОН– | +0,815 | III Li…Ag | -3,01<E< +0,815 |
| Кислая среда в присутствии растворенного кислорода и влажная атмосфера промышленных районов | О2+ 4Н+ +4е = 2Н2О | +1,23 | IV Li…Bi | -3,01<E< +1,23 |
*Анодные процессы для всех металлов можно представить в общем виде:
Ме – пе = Меп+
Кинетика коррозионного процесса
Термодинамика определяет возможность протекания коррозионного процесса, кинетика определяет его скорость. Скорость коррозии определяется величиной коррозионного тока, то есть количеством электричества, протекающего через поверхность металлического изделия в единицу времени. Сила коррозионного тока определяется из закона Ома:
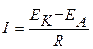 ,
,
где R - общее сопротивление протекания коррозионного процесса, которое включает в себя поляризационное сопротивление катодного и анодного процессов; сопротивление коррозионной среды или пленок продуктов коррозии, образующихся на поверхности металла.
Пленки продуктов коррозии (Fe2O3·nH2O, Al2O3, Zn(OH)2 и т.д.) обладают высоким электрическим сопротивлением, вызывают поляризацию катодного и анодного процессов и, следовательно, могут тормозить процесс коррозии. В качестве примера можно назвать такие металлы, как хром и алюминий, которые относятся к активным металлам (EoCr/Cr3+ = – 0,74B; EoAl/Al3+ = – 1,66B). В коррозионных средах, содержащих кислород, на их поверхности образуется тонкая сплошная оксидная пленка, обладающая высоким сопротивлением и поэтому значительно тормозящая процесс коррозии.
Таким образом, кинетический фактор часто определяет реальную скорость коррозионного процесса, т.е. процесс может быть термодинамически возможным, и он начинает протекать, однако продукты коррозии, в некоторых случаях образующие сплошные защитные пленки, значительно тормозят процесс коррозии, и металл пассивируется. Самопассивирующимися металлами являются Be, Al, Ti, Cr, Ni и некоторые другие. Анодный процесс окисления этих металлов сопровождается образованием оксида:
2Сr0 - 6e + 3H2O → Cr2O3 + 6H+
Методы защиты металлов от коррозии
В технике для защиты металлов от коррозии используются различные методы:
· легирование
· нанесение различных покрытий
· электрохимическая защита
· изменение свойств среды
В зависимости от условий эксплуатации изделий может быть выбран тот или иной метод защиты от коррозии. В наиболее агрессивных средах (в морской воде, в почве и т.д.) применяют комбинированные методы защиты.
Легирование металлов – это создание поверхностного экранирующего слоя, т.е. введение элементов, предотвращающих структурную коррозию.
Неметаллические защитные покрытия – это лаки, краски, смазки, керамика, резина и т.п.
Материалами для металлических защитных покрытий могут быть как чистые металлы (Zn, Cd, Al, Ni, Cr, Cu, Ag и др.), так и их сплавы (бронза, латунь). По характеру поведения металлических покрытий при коррозии различают катодные и анодные покрытия.
Металлы анодного покрытия имеют меньшее (более отрицательное) значение потенциала, чем потенциал защищаемого металла; последний является в этом случае катодом и не коррозирует. Примером является оцинкованное железо.
Катодными являются металлические покрытия, имеющие в данной среде большее значение потенциала, чем потенциал основного металла. Например, Sn, Cu, Ni, Ag на стали являются катодными покрытиями. При повреждении или наличии в покрытии пор возникают коррозионные элементы, в которых основной материал служит анодом и растворяется, а материал покрытия – катодом, на котором происходит выделение водорода или поглощение кислорода. Таким образом, катодные покрытия могут защищать металл в отсутствии пор или повреждений.
К электрохимическим методам защиты относятся протекторная, катодная и анодная защита.
Протектор – это кусок металла, имеющего более отрицательное значение стандартного электродного потенциала, чем металл защищаемого изделия, подключенный к защищаемому изделию. При воздействии агрессивной среды в первую очередь разрушается протектор.
Для подавления процесса коррозии при катодной или анодной защите изделие подключают к источнику внешнего тока так, чтобы оно стало катодом (процесс коррозии подавляется) или анодом (в последнем случае устанавливается напряжение, соответствующее зоне пассивации на анодной поляризационной кривой, и поверхность изделия пассивируется).
Для изменения свойств агрессивной среды используют удаление окислителей из среды (деаэрация) или введение ингибиторов.
Примеры решения типовых задач
Пример 1. Описание процесса коррозии металла и составление схемы гальванического элемента.
Задача 1. Опишите процесс коррозии железной пластинки с включениями меди, опущенной в раствор соляной кислоты. Приведите схему образующегося при этом гальванического элемента.
Решение. Исходя из положений металлов в ряду напряжений или по таблице сравнивая величины стандартных электродных потенциалов, видим, что железо является более активным металлом ( 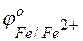 = –0,44 В) и в образующейся гальванической паре железо будет анодом. Медь является катодом (
= –0,44 В) и в образующейся гальванической паре железо будет анодом. Медь является катодом ( 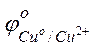 = +0,337 В). Железный анод растворяется, железо окисляется, а на медном катоде выделяется водород;
= +0,337 В). Железный анод растворяется, железо окисляется, а на медном катоде выделяется водород; 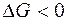 , следовательно, процесс протекает самопроизвольно.
, следовательно, процесс протекает самопроизвольно.
Схема работающего при коррозии гальванического элемента:
 |  | ||
(-) Feo /Fe2+ || HCl || (Cu) H2 /2H+ (+)
Анодный процесс: Feo – 2е  Fe2+;
Fe2+;
Катодный процесс: 2 H+ + 2е  H2.
H2.
Задача 2. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если пара металлов находится в кислой среде (в соляной кислоте). Приведите схему образующегося при этом гальванического элемента.
Решение. Исходя из положений металлов в ряду напряжений или по таблице сравнивая величины стандартных электродных потенциалов, видим, что хром является более активным металлом ( 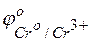 = –0,744 В), и в образующейся гальванической паре хром будет анодом. Медь является катодом (
= –0,744 В), и в образующейся гальванической паре хром будет анодом. Медь является катодом ( 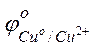 = +0,337 В). Хромовый анод растворяется, а на медном катоде выделяется водород.
= +0,337 В). Хромовый анод растворяется, а на медном катоде выделяется водород.
Схема работающего при коррозии гальванического элемента
 |
(-) 2Cro /2Cr3+ || HCl || (Cu) 3H2 /6H+ (+)
Анодный процесс: Cro – 3е  Cr3+
Cr3+
Катодный процесс: 2 H+ + 2е  H2
H2
Следовательно, окисляется хром.
Задача 3. Опишите коррозионное поведения латуни (сплава цинка с медью) в кислой среде.
Решение. На поверхности этого сплава присутствуют атомы меди и атомы цинка. Цинк имеет отрицательное значение потенциала 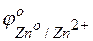 = – 0,763 В), легче окисляется и служит анодом в коррозионном гальваническом элементе. Медь имеет положительное значение электродного потенциала (
= – 0,763 В), легче окисляется и служит анодом в коррозионном гальваническом элементе. Медь имеет положительное значение электродного потенциала ( 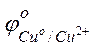 = +0,337 В), на ее поверхности идет процесс восстановления какого-либо окислителя, содержащегося в коррозионной среде.
= +0,337 В), на ее поверхности идет процесс восстановления какого-либо окислителя, содержащегося в коррозионной среде.
Коррозия латуни в кислой среде протекает по схеме:



(-) Zno /Zn2+ || H2SO4|| (Cu) H2 /2H+ (+)
Анодный процесс: Zn – 2e  Zn
Zn 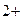 (окисление);
(окисление);
Катодный процесс: 2H  + 2e
+ 2e  H2 (восстановление).
H2 (восстановление).
В кислых средах коррозионный процесс протекает с водородной деполяризацией, то есть деполяризатором (окислителем), способным снимать электроны с катодных участков, служат ионы водорода. Суммарное уравнение процесса коррозии латуни можно представить таким образом:
Zn + H2SO4  ZnSO4 + H2
ZnSO4 + H2 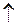 (ZnSO4) - продукт коррозии.
(ZnSO4) - продукт коррозии.
Задача 4. Опишите коррозионное поведение стали (сплав железа с углеродом) во влажной атмосфере воздуха.
Решение. На поверхности этого сплава присутствуют атомы железа и атомы углерода (точнее соединение железа с углеродом Fe3C)
Железо имеет отрицательное значение потенциала ( 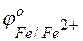 = –0,44 В), легче окисляется и служит анодом в коррозионных гальванических элементах. Углерод имеет положительное значение электродного потенциала, на его поверхности идет процесс восстановления какого-либо окислителя, содержащегося в коррозионной среде (во влажной атмосфере воздуха коррозионный процесс протекает с кислородной деполяризацией):
= –0,44 В), легче окисляется и служит анодом в коррозионных гальванических элементах. Углерод имеет положительное значение электродного потенциала, на его поверхности идет процесс восстановления какого-либо окислителя, содержащегося в коррозионной среде (во влажной атмосфере воздуха коррозионный процесс протекает с кислородной деполяризацией):
анод (-) Feo /Fe2+ || O2 , H2O || C (+) катод
Анодный процесс: 2Feo – 4е  2Fe2+(окисление);
2Fe2+(окисление);
Катодный процесс: O2 +2H2O+4e = 4OH– (восстановление).
Суммарное уравнение: 2Fe + O2 +2H2O = 2Fe(OH)2 – продукт коррозии.
Продукт коррозии Fe(OH)2 кислородом воздуха окисляется до Fe(OH)3:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
 4 Fe(ОН)2 + ОН– +1e
4 Fe(ОН)2 + ОН– +1e  Fe(ОН)3 (окисление);
Fe(ОН)3 (окисление);
1 O2 +2H2O+4e  4OH– (восстановление).
4OH– (восстановление).
На воздухе из пленки гидроксида железа (III) частично испаряется вода и образуется рыхлый слоистый продукт – ржавчина: mFe2O3 .nH2О.
Пример 2. Определение катодного и анодного типа защиты металла от коррозии.
Задача 1. Опишите коррозионное поведение луженого и оцинкованного железа во влажной атмосфере воздуха. Какое железо (луженое или оцинкованное) более надежно защищено от коррозии.
Решение. Железо, олово и цинк имеют следующие значения стандартных электродных потенциалов: –0,44 В, –0,14 В и –0,76 В соответственно. По сравнению с железом олово является менее активным металлом и будет служить катодным покрытием, т.е. надежно защищать металл в случае отсутствия пор или повреждений. При повреждении покрытия железо, являясь анодом, будет окисляться, а на поверхности катода (олова) будет протекать процесс восстановления (кислородная деполяризация):
анод (-)Feo /Fe2+ || O2, H2O || Sn/Sn2+ (+) катод
Анодный процесс: 2Feo – 4е  2Fe2+(окисление);
2Fe2+(окисление);
Катодный процесс: O2 +2H2O+4e  4OH– (восстановление).
4OH– (восстановление).
Продукт коррозии Fe(OH)2 кислородом воздуха окисляется до Fe(OH)3:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Цинк является металлом анодного покрытия, т.к. имеет меньшее (более отрицательное) значение потенциала, чем потенциал защищаемого металла; железо является в этом случае катодом и не коррозирует:
анод (-) Zno /Zn2+ || O2, H2O || Fe/Fe2+ (+) катод
Анодный процесс: 2Zn – 4e ® 2Zn 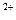 (окисление);
(окисление);
Катодный процесс: O2 +2H2O+4e  4OH– (восстановление).
4OH– (восстановление).
Продукт коррозии – Zn (OH)2 .
Таким образом, катодные покрытия могут защищать металл в отсутствии пор или повреждений, а анодные надежно защищают металл, так как сами окисляются.
1.10. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексными соединениями называются вещества, в структуре которых можно выделить центральный атом или катион металла, окруженный расположенными вокруг него в строгом геометрическом порядке заместителями. Основная особенность комплексных соединений – присутствие в их составе элементов, проявляющих дополнительные валентности. Как следствие, значение степеней окисления этих элементов не совпадают с их валентностями.
Другой отличительной особенностью комплексных соединений является наличие в них структурной группировки, называемой координационной сферой. Она состоит из центральной частицы – иона или атома – комплексообразователя и прочно связанных с ней заместителей – лигандов (от латинского ligare – связывать), которыми могут быть ионы противоположного знака, нейтральные молекулы, а также функциональные группы, принадлежащие к сложным молекулам или ионам. Число лигандов, расположенных вокруг комплексообразователя, называется координационным числом (КЧ).
В формулах комплексных соединений координационная сфера выделяется квадратными скобками. Ее заряд равен алгебраической сумме зарядов комплексообразователя и лигандов. Противоионы, располагающиеся снаружи внутренней сферы, составляют внешнюю сферу комплексного соединения.
Примерами комплексных соединений могут служить Na3[Al(OH)6], [Cr(H2О)6]Cl3, [Ni(NH3)6](NO3)2, K2[Zn(CN)4], Na2[Be(OH)4].
Комплексные соединения можно рассматривать как продукты объединения нескольких молекул обычных веществ: Al(OH)3.3NaOH, CrCl3.6H2O, Ni(NO3)2.6NH3, Zn(CN)2.2KCN, Be(OH)2.2NaOH.
Образование комплексных соединений объясняется тем, что центральный ион (или атом) более сильно взаимодействует с лигандами, чем с другими имеющимися в молекуле частицами и поэтому удерживает лиганды около себя, образуя координационную сферу. Это взаимодействие обусловлено, в основном, тремя факторами: электростатическим притяжением, поляризацией и возникновением донорно-акцепторных связей за счет неподеленных электронных пар лигандов.

Пространственное расположение частиц в комплексном соединении Na3[Al(OH)6].
Как правило, комплексообразователями являются атомы или чаще катионы d-металлов, имеющие достаточное число вакантных орбиталей и выполняющие функции акцептора электронов при образовании связей с лигандами. Поэтому в качестве лигандов могут выступать частицы, являющиеся донорами электронов и содержащие на атоме–доноре частичный или целый отрицательный заряд. К таким частицам относятся отрицательно заряженные ионы F–, Cl–, OH–, CH3COO–, CN–, NO2–, CO32–, CNS–, и т.п.) или полярные молекулы (NH3, H2O, CO и т.п.), обладающие неподеленными парами электронов. Иногда функцию лигандов выполняют молекулы, имеющие p-электроны, например, бензол, алкены и алкины.
По составу координационной сферы комплексные соединения подразделяются на соединения, содержащие молекулярные лиганды, и соединения, содержащие анионные лиганды.
К комплексным соединениям, содержащим молекулярные лиганды относятся:
а) аквакомплексы или гидраты – комплексные соединения, в которых лигандами являются молекулы воды, например,
[Cu(H2O)4]SO4, [Cr(H2O)6]Cl3, [Mg(H2O)6]SO4;
б) аммиакаты – комплексные соединения, в которых в качестве лигандов выступают молекулы аммиака, например,
[Pt(NH3)6]Cl4, [Zn(NH3)4]SO4, [Ag(NH3)2]Cl;
в) карбонилы – комплексные соединения, в которых лигандами являются молекулы оксида углерода (II), например,
[Fe(CO)5], [Ni(CO)4], [Co2(CO)8].
Последние являются примером комплексных соединений без внешней сферы.
К комплексным соединениям, содержащим анионные лиганды, относятся:
а) ацидокомплексы – комплексные соединения, в которых в качестве лигандов выступают кислотные остатки: Cl–, Br–, J–, CN–, NCS– и др., например,
К3[Fe(CN)6], Na2[PtCl6], К2[HgJ4] ;
б) гидроксокомплексы – комплексные соединения, в которых в качестве лигандов выступают гидроксил-анионы, например,
К3[Al(OH)6], Na2[Zn(OH)4), К2[Be(OH)4].
Согласно правилам IUPAC название комплексов включает название лигандов и комплексообразователя, причем вначале указываются лиганды (в алфавитном порядке), а затем комплексообразователь. К анионным лигандам добавляют окончание –о, например, CO32– – карбонато, NCS– – тиоцианато, NO2– – нитрито, CN– – циано, N3– – азидо, OH– – гидроксо. Нейтральные лиганды имеют те же названия, что и молекулы, за исключением H2O (аква), NH3 (аммин), СО (карбонил). Если в координационной сфере присутствуют различные типы лигандов, то они указываются в алфавитном порядке. Число лигандов в комплексе обозначают греческими приставками ди–, три–, тетра–, пента–, гекса– и т.д. Название комплексных анионов содержит суффикс –ат. Степень окисления металла–комплексообразователя указывается в круглых скобках после его названия. Если металл образует ион с одной степенью окисления, то она в название комплекса может не включаться. В целом название комплексного соединения состоит из названия внешней и внутренней сферы (комплекса). При этом как и в случае обычных неорганических соединений в начале указывается название аниона в именительном падеже, а затем катиона – в родительном. Если комплексное соединение не содержит внешней сферы, то указывается только его название в именительном падеже. Нижеприведенные примеры иллюстрируют изложенные правила:
[Cr(NH3)6]Cl3 – хлорид гексаамминхрома (III);
K4[Fe(CN)6] – гексацианоферрат (II) калия;
[Co(NH3)3Cl3] – триамминтрихлорокобальт (III);
[Cr(H2O)3F3] – триакватрифторохром (III);
Na[Al(OH)4] – тетрагидроксоалюминат натрия;
[CoCl2(H2O)(NH3)3]2SO4 – сульфат акватриамминдихлорокобальта (III).
Как правило, комплексные соединения являются хорошими электролитами и легко диссоциируют в водных растворах на комплексные ионы и противоионы внешней сферы:
К2[Zn(CN)4]  2K+ + [Zn(CN)4]2–
2K+ + [Zn(CN)4]2–
[Co(NH3)6](NO3)2  [Co(NH3)6]2+ + 2NO3–
[Co(NH3)6]2+ + 2NO3–
При этом сами комплексные ионы достаточно устойчивы и диссоциируют в незначительной степени. Поэтому наиболее характерными реакциями комплексных соединений являются реакции обменного взаимодействия, в результате которых изменяется только внешняя сфера, а состав комплексной частицы остается неизменным. Примерами таких превращений являются реакции красной и желтой кровяной соли с водорастворимыми солями Fe(II) (уравнение а) и Fe(III) (уравнение б):
а) 3FeSO4 + 2K3[Fe(CN)6]  Fe3[Fe(CN)6]2 + 3K2SO4
Fe3[Fe(CN)6]2 + 3K2SO4
гексацианоферрат (III) гексацианоферрат (III)
калия железа (II)
(красная кровяная соль) (турнбулева синь)
или в сокращенном ионном виде: 3Fe2+ + 2[Fe(CN)6]3–  Fe3[Fe(CN)6]2;
Fe3[Fe(CN)6]2;
б) 2Fe2(SO4)3 + 3K4[Fe(CN)6]  Fe4[Fe(CN)6]3 + 6K2SO4
Fe4[Fe(CN)6]3 + 6K2SO4
гексацианоферрат (II) гексацианоферрат (II)
калия железа (III)
(желтая кровяная соль) берлинская лазурь)
или в сокращенном ионном виде: 4Fe3+ + 3[Fe(CN)6]4–  Fe4[Fe(CN)6]3.
Fe4[Fe(CN)6]3.
Прочность комплексных ионов в растворах характеризуется равновесием их диссоциации, например:
[Zn(CN)4]2–  Zn2+ + 4CN–
Zn2+ + 4CN–
[Co(NH3)6]2+  Co2+ + 6NH3
Co2+ + 6NH3
Мерой прочности комплексов является константа равновесия их диссоциации, которая называется константой нестойкости
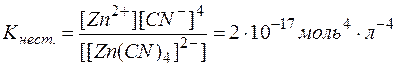

Низкие значения этих констант указывают на высокую прочность комплексов, причем чем меньше Кнест., тем прочнее комплекс.
Разрушение комплексов сводится к разрушению его координационной сферы. Принципиальный путь такого разрушения лежит через вовлечение свободных лигандов или ионов-комплексообразователей в новые реакции, обеспечивающие их связывание и смещение равновесия диссоциации комплексов в правую сторону. При этом эффективность разрушения комплексов должна оцениваться на основе анализа сложного равновесия, состоящего из равновесия диссоциации комплекса и равновесия связывания продуктов диссоциации.
Методы получения комплексных соединений.
Аквакомплексы получают взаимодействием водорастворимых солей, содержащих комплексообразователь, с водой
MgSO4 + 6H2O  [Mg(H2O)6]SO4
[Mg(H2O)6]SO4
Аммиакаты получают взаимодействием гидроксида аммония с водорастворимыми солями, содержащими комплексообразователь. Реакция имеет ступенчатый характер: первоначально образуется нерастворимый гидроксид металла комплексообразователя, который под действием избытка гидроксида аммония переходит в водорастворимое комплексное основание. Суммирование левых и правых частей уравнений этих реакций приводит к уравнению брутто-реакций:
CuSO4 + 2NH4OH  Cu(OH)2 ¯+ (NH4)2SO4
Cu(OH)2 ¯+ (NH4)2SO4
Cu(OH)2 + 4NH4OH  [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 4H2O
___________________________________________
CuSO4 + 6NH4OH  [Cu(NH3)4](OH)2 + (NH4)2SO4 + 4H2O
[Cu(NH3)4](OH)2 + (NH4)2SO4 + 4H2O
Чтобы получить во внешней сфере необходимый анион, на полученное комплексное основание действуют эквивалентным количеством соли, содержащей этот анион и катион, дающий с гидроксид–анионом нерастворимую форму
[Cu(NH3)4](OH)2 + CuCl2  [Cu(NH3)4]Cl2 + Cu(OH)2
[Cu(NH3)4]Cl2 + Cu(OH)2 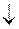
Гидроксокомплексы получают воздействием на водорастворимую соль комплексообразователя избытком щелочного агента. Эта реакция также имеет ступенчатый характер:
AlBr3 + 3NaOH  Al(OH)3
Al(OH)3 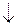 + 3NaBr
+ 3NaBr
Al(OH)3 + 3NaOH  Na3[Al(OH)6]
Na3[Al(OH)6]
________________________________
AlBr3 + 6 NaOH  Na3[Al(OH)6] + 3NaBr
Na3[Al(OH)6] + 3NaBr
Условием образования гидрокомплексов является амфотерный характер металла–комплексообразователя.
Ацидокомплексы получают взаимодействием водорастворимой соли комплексообразователя с избытком водорастворимого соединения, содержащего лиганд. Первоначально образуется обычная соль комплексообразователя с лигандом, которая под действием избытка лиганд-содержащего агента переходит в комплексное соединение:
Hg(NO3)2 + 2KI  HgI2
HgI2 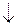 + 2KNO3
+ 2KNO3
HgI2 + 2KI  K2[HgI4]
K2[HgI4]
 |
Hg(NO3)2 + 4KI  K2[HgI4] + 2KNO3
K2[HgI4] + 2KNO3
Примеры решения типовых задач.
Пример 1. Составление формулы и диссоциация комплексного соединения, вычисление заряда комплексного иона.
Задача 1. Составьте формулу сульфата гексаамминкобальта (II). Напишите уравнение диссоциации этого соединения в водном растворе, определите заряд комплексного иона.
Решение. Координационное число кобальта (II), согласно названию (гексаамминкобальт), равно шести, поэтому он образует комплексный ион [Co(NH3)6]2+. Заряд иона равен +2, так как ион кобальта имеет заряд +2, а молекулы аммиака нейтральны.
Комплексное соединение имеет формулу [Co(NH3)6]SO4 и диссоциирует в водном растворе на комплексный ион и противоион внешней сферы:
[Co(NH3)6]SO4 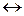 [Co(NH3)6]2+ + SO42-.
[Co(NH3)6]2+ + SO42-.
Пример 2. Способы разрушения комплексных соединений.
Задача 1. Предложите способ разрушения комплексного соединения [Co(NH3)6]SO4..
Решение. Комплекс [Co(NH3)6]2+ содержит в качестве лигандов молекулы аммиака, обладающие основными свойствами. Поэтому естественным способом разрушения этих комплексов является связывание молекул аммиака протонными кислотами. Процесс разрушения комплексов можно представить сложным равновесием, являющегося сочетанием простых равновесий (1) и (2):
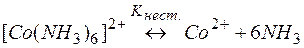
| (1) | |
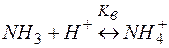
| (2) | |
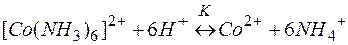
| (3) |
Умножая уравнение (2) на 6 и суммируя левые и правые части равновесий (1) и (2), приходим к суммарному уравнению реакции (3). Константы равновесий (1), (2) и (3) выражаются через их равновесные концентрации следующими равенствами:

Сопоставляя эти выражения, можно видеть
К= Кнест..Кв6 (4)
Подставляя табулированные значения для Кнест. и Кв в выражение (4), имеем:
К = 7,8 . 10-6 . (1,73 . 109)6 = 2,09 . 1050
Полученное значение константы равновесия К очень велико. Это указывает на то, что суммарное равновесие (3) нацело смещено в правую сторону, т.е. комплекс [Co(NH3)6]2+ полностью разрушен.
Задача 2. Можно ли разрушить комплексное соединение [Ag(NH3)2]NO3 воздействием соли KI?
Решение. Представим процесс разрушения комплекса системой простых равновесий (5) и (6):
 (5)
(5)
 (6)
(6)
___________________________________________________________
 (7)
(7)
Суммирование левых и правых частей этих равновесий приводит к уравнению разрушения комплекса (7). По аналогии с вышеприведенными рассуждениями в примере 1 можно показать, что
К = Кнест. . Кос. (8)
Подставляя в равенство (8) табулированное значение для Кнест.. и Кос. приходим к значению К:
К = 7,94 . 10–8 . 1016 = 7,94 . 108

 Высокое значение константы К указывает на практически полное смещение равновесия (7) в правую сторону, т.е. комплекс [Ag(NH3)2]+ разрушен.
Высокое значение константы К указывает на практически полное смещение равновесия (7) в правую сторону, т.е. комплекс [Ag(NH3)2]+ разрушен.
Задача 3. Можно ли разрушить комплексное соединение Na[Ag(CN)2] воздействием на него KCl? 
Решение. Процесс разрушения комплекса [Ag(CN)2]– можно представить равновесиями (9) и (10):
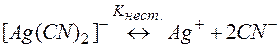 (9)
(9)
 (10)
(10)
___________________________________________________________
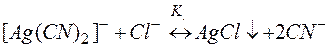 (11)
(11)
Суммирование левых и правых частей уравнений (9) и (10) приводит к равновесию разрушения комплекса (11). Можно показать, что
К = Кнест. . Кос.
При подстановке численных значений Кнест. и Кос. в последнее выражение имеем
К = 10–21 . 0,912 . 1010 = 0.912 . 10–11
Низкое значение константы К указывает, что равновесие брутто-реакции (11) практически нацело смещено в левую сторону. Таким образом, комплекс [Ag(CN)2]– невозможно разрушить воздействием анионов Cl–.
1.11. ЗАДАЧИ К КОНТРОЛЬНОЙ РАБОТЕ №1
1. Определите количество вещества эквивалента и молярную массу эквивалентов фосфора, кислорода и брома в соединениях PH3, H2O, HBr если масса вещества 3,54 г.
2. В какой массе NaOH содержится то же количество эквивалентов, что и в 140 г KOH.
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалента этого металла.
4. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалента этого металла.
5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите молярную массу эквивалента, молярную и атомную массы этого элемента.
6. Чему равен при н.у. эквивалентный объем водорода? Вычислите молярную массу эквивалента металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.).
7. Вычислите количество вещества эквивалента и молярную массу эквивалента Н3РО4 в реакциях образования: а) гидроортофосфата; б) дигидроортофосфата; в) ортофосфата, если масса ортофосфорной кислоты во всех реакциях 12, 38 г.
8. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалента металла и его оксида. Чему равна молярная и относительная атомная масса этого металла?
9. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.) Вычислите молярную массу эквивалента, молярную массу и относительную атомную массу этого металла.
10. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите молярную массу эквивалента этого металла.
11. Напишите уравнения реакций Fe(OH)3 с хлороводородной (соляной) кислотой, в которых образуются следующие соединения железа: а) хлорид дигидроксожелеза (III); б) хлорид гидроксожелеза (III); в) хлорид железа (III). Вычислите количество вещества эквивалента и молярную массу эквивалента Fe(OH)3 в каждой из этих реакций.
12. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнение реакций этих веществ с КОН и определите для этих веществ количество вещества эквивалентов и молярные массы эквивалентов, если массы веществ 32,45 г.
13. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) хлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите для этих веществ количество вещества эквивалентов и молярные массы эквивалентов , если массы веществ 18, 43 г.
14. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалента металла и его оксида. Чему равны молярная и относительная атомная массы металла? Ответ: 27,9 г/моль; 35,9 г/моль; 55,8 г/моль; 55,8.
15. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную массу эквивалента, молярную и относительную атомную массы металла.
16. Исходя их молярной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах.
17. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NaOH. Вычислите количество вещества эквивалента, молярную массу эквивалента и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции.
18. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите количество вещества эквивалента, молярную массу эквивалента и основность кислоты. На основании расчета напишите уравнение реакции.
19. Вычислите число атомов азота в 20 г карбамида (NH2)2CO, содержащего 10% неазотистых примесей.
20. В тонне морской воды содержится около 50 миллиардов атомов золота. Приняв, что 30 капель воды имеют массу 1 г, вычислите массу золота в 1 г морской воды.
21. Сколько молекул оксида серы (IV) образуется при сжигании 2 г серы?
22. При сгорании металла массой 3 г образуется его оксид массой 5,67 г. Степень окисления металла в оксиде равна +3. Что это за металл?
23. Во сколько раз в земной коре атомов кислорода больше, чем атомов кремния? Массовые доли кислорода и кремния равны 0,47 и 0,295 соответственно.
24. При взаимодействии 1,04 г некоторого металла с раствором кислоты выделилось 0,448 л водорода (н.у.). Определите этот металл.
25. Сколько граммов хлорида железа (III) необходимо для приготовления 2 л 0,5н раствора?
26. Какая масса серной кислоты содержится в 1 л 0,5н раствора?
27. Сколько граммов хлорида бария содержится в 25 мл 0,5н раствора?
28. Какой объем 0,2н раствора Н2SO4 потребуется для нейтрализации 500 мл 0,1н раствора NaOH?
29. Какой объем 0,1н раствора НCl потребуется на нейтрализацию раствора, содержащего 0,56 г КOH?
30. Какова нормальность раствора NaOH, если на нейтрализацию 150 мл этого раствора пошло 80 г 5% раствора серной кислоты?
31. При взаимодействии фосфата кальция с углеродом и оксидом кремния  получено 3,1 г фосфора. Определите массы эквивалентов углерода и фосфата кальция в этой реакции.
получено 3,1 г фосфора. Определите массы эквивалентов углерода и фосфата кальция в этой реакции.
32. Сколько миллилитров раствора 0,1н К2SO4 потребуется для осаждения сульфата бария из 50 г 5%-го раствора?
33. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
34. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
35. Какое максимальное число электронов могут занимать s-, p-, d- и f-орбитали данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером 31.
36. Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4p? Почему? Напишите электронную формулу атома элемента с порядковым номером 21.
37. Какие орбитали атома заполняются электронами раньше: 4d или 5s; 6s или 5p? Почему? Напишите электронную формулу атома элемента с порядковым номером 43.
38. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных 3d-орбиталей у атомов последнего элемента?
39. Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных 3d-орбиталей в атомах этих элементов?
40. Сколько свободных d-орбиталей содержится в атомах Sc, Ti, V? Напишите электронные формулы атомов этих элементов.
41. Пользуясь правилом Гунда, распределите электроны по квантовым ячейкам, отвечающим низшему энергетическому состоянию атомов: хрома, фосфора, серы, германия, никеля.
42. Для атома бора возможны два различных электронных состояния  и
и 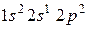 . Как называют эти состояния? Как перейти от первого состояния ко второму?
. Как называют эти состояния? Как перейти от первого состояния ко второму?
43. Атому какого из элементов отвечает каждая из приведенных электронных формул:
а)  ;
;
б) 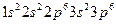 ;
;
в) 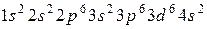 ;
;
г) 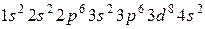 ;
;
д) 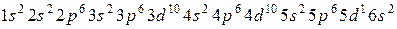 ?
?
44. Атомам каких элементов и каким состояниям этих элементов отвечают следующие электронные формулы 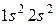 и
и  ;
;  и
и  ?
?
45. Пользуясь правилом Гунда, распределите электроны по квантовым ячейкам, отвечающим высшему энергетическому состоянию атомов: марганца, азота, кислорода, кремния, кобальта.
46. Напишите электронную конфигурацию атомов, пользуясь электронными формулами для элементов с порядковыми номерами 12, 25, 31, 34, 45.
47. Пользуясь правилом Гунда, распределите электроны по энергетическим ячейкам, соответствующим низшему энергетическому состоянию, для атомов элементов с порядковыми номерами 26, 39, 49, 74, 52.
48. Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента, неверны: а) 1s22s22p53s1; б) 1s22s22p6; в) 1s22s22p63s23p63d4; г) 1s22s22p63s23p64s2; д) 1s22s22p63s23d2? Почему? Атомам каких элементов отвечают правильно составленные электронные формулы?
49. Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая,  что у первого происходит «провал» одного 4s-электрона на 3d-подуровень. Чему равен максимальный спин d-электронов у атомов первого и p-электронов у атомов второго элемента?
что у первого происходит «провал» одного 4s-электрона на 3d-подуровень. Чему равен максимальный спин d-электронов у атомов первого и p-электронов у атомов второго элемента?
50. В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- или d12-электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны.
51. Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит «провал» одного 5s-электрона на 4d-подуровень. К какому электронному семейству относится каждый из этих элементов?
52. Определите по правилу Клечковского порядок заполнения электронами подуровней в атомах элементов, если их суммы n+1 соответственно равны 4, 5 и 6?
53. Сколько свободных f-орбиталей содержится в атомах элементов с порядковыми номерами 61, 62, 91, 92? Пользуясь правилом Гунда, распределите электроны по энергетическим ячейкам для атомов этих элементов.
54. В атомах каких элементов IV периода наибольшее число непарных d-электронов? Представьте структуру d-подуровней атомов этих элементов.
55. Составьте электронные формулы еще не открытых элементов № 108 и 113 и укажите, какое место они займут в периодической системе.
56. Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
57. Изотоп никеля-57 образуется при бомбардировке α-частицами ядер атомов железа-54. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
58. Изотоп кремния-30 образуется при бомбардировке α-частицами ядер атомов алюминия-27. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
59. Изотоп углерода-11 образуется при бомбардировке протонами ядер атомов азота-14. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
60. Сколько и какие значения может принимать магнитное квантовое число ml при орбитальном числе l = 0, 1, 2 и 3? Какие элементы в периодической системе называют s-, p-, d- и f-элементами? Приведите примеры.
61. Какие значения могут принимать квантовые числа n, l, ml и mS, характеризующие состояние электронов в атоме? Какие значения они принимают для внешних электронов атома магния?
62. Квантовые числа для электронов внешнего энергетического уровня атомов некоторых элементов имеют следующие значения: n = 4; l = 0; ml = 0; mS =  . Напишите электронные формулы атомов этих элементов и определите сколько свободных 3d-орбиталей содержит каждый их них.
. Напишите электронные формулы атомов этих элементов и определите сколько свободных 3d-орбиталей содержит каждый их них.
63. Для атома с электронной структурой  впишите в таблицу значения четырех квантовых чисел: n, l, ml, mS, определяющие каждый изэлементов в нормальном состоянии:
впишите в таблицу значения четырех квантовых чисел: n, l, ml, mS, определяющие каждый изэлементов в нормальном состоянии:
| Квантовые числа | Номер электрона | ||||||||
| n l ml ms |
64. Энергетическое состояние внешнего электрона атома описывается следующими значениями квантовых чисел: n=4, l=0, ml=0. Атомы каких элементов имеют такой электрон? Составьте электронные формулы атомов этих элементов. Напишите все квантовые числа эля электронов атомов: а) лития, бериллия, углерода; б) азота, кислорода, фтора.
65. Напишите значения квантовых чисел ml и mS для тех четырнадцати электронов, для которых главное и орбитальное число соответственно равны 4 и 3.
66. Напишите электронные формулы атомов элементов и назовите их, если значения квантовых чисел (n, l, ml, mS) электронов наружного электронного слоя следующие:
а) 2, 0, 0, +  ; 2, 0, 0, -
; 2, 0, 0, -  ;
;
б) 3, 1, -1, -  ; 3, 1, +1, -
; 3, 1, +1, -  .
.
Охарактеризуйте квантовыми числами следующие состояния электронов.
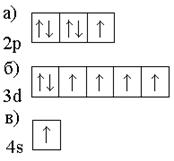
67. Напишите электронные формулы атомов элементов и назовите их, если значения квантовых чисел (n, l, ml, mS) электронов наружного (последнего) и предпоследнего электронных слоев следующие:
а) 6, 0, 0, +  ; 6, 0, 0, -
; 6, 0, 0, -  ; 6, 1, -1, +
; 6, 1, -1, +  ;
;
б) 3, 2, -2, +  ; 3, 2, -1, +
; 3, 2, -1, +  ; 4, 0, 0, +
; 4, 0, 0, +  ; 4, 0, 0, -
; 4, 0, 0, -  .
.
68. Исходя из положения германия и технеция в периодической системе, составьте формулы мета- и ортогерманиевой кислот, и оксида технеция, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
69. Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и p-элементов в группах периодической системы с увеличением порядкового номера? Почему?
70. Что такое электроотрицательность? Как изменяется электроотрицательность р-элементов в периоде, в группе периодической системы с увеличением порядкового номера? Почему?
71. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента.
72. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется кислотно-основный характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия.
73. Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой их этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов.
74. Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
75. У какого элемента четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой их этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена.
76. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения?
77. У какого из р-элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атома этих элементов.
78. Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ba(OH)2 или Mg(OH)2; Ca(OH)2 или Fe(OH)2; Cd(OH)2 или Sr(OH)2?
79. Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: CuOH или Cu(OH)2; Fe(OH)2 или Fe(OH)3; Sn(OH)2 или Sn(OH)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
80. Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой степени окисления. Как называются соответствующие соединения?
81. Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
82. Хром образует соединения, в которых он проявляет степени окисления +2, +3, +6. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающие амфотерность гидроксида хрома (III).
83. Атомные массы элементов в периодической системе непрерывно увеличиваются, тогда как свойства простых тел изменяются периодически. Чем это можно объяснить? Дайте мотивированный ответ.
84. Какова современная формулировка периодического закона? Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя и имеют большую атомную массу?
85. Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
86. Атомы каких элементов четвертого периода периодической системы образуют оксид, отвечающий их высшей степени окисления Э2О5? Какой из них дает газообразное соединение с водородом? Составьте формулы кислот, соответствующих этим оксидам, и изобразите их графически.
87. Исходя из величин потенциалов ионизации, укажите, какой из приведенных элементов: Be, Mg, Ca, Sr, Ba – проявляет наиболее ярко выраженные металлические свойства?
88. Укажите, как в приведенном ряду элементов O, S, Se, Te изменяется способность принимать электроны, если известны величины электроотрицательности атомов этих элементов.
89. Как изменяются свойства элементов II периода периодической системы с увеличением заряда ядра атома элемента? Ответ подтвердите характером формирования электронных оболочек атомов элементов.
90. Укажите, какое из сравниваемых двух соединений является более сильным основанием: а) NaOH или CsOH; б) Ca(OH)2 или Ba(OH)2; в) Zn(OH)2 или Cd(OH)2.
91. Как меняется восстановительная способность и сила кислот в ряду HF→ HCl→ HBr → HI?
92. У какого из элементов четвёртого периода – ванадия или мышьяка – сильнее выражены металлические свойства и почему?
93. Какие водородные соединения образуют p-элементы второго периода? Как изменяется прочность и кислотные свойства этих соединений в периоде слева направо?
94. Элемент в периодической системе имеет порядковый номер 25. Какие оксиды образует этот элемент? Какие свойства проявляют оксиды этого элемента? Образует ли этот элемент газообразные соединения с водородом?
95. Определите степень окисления фосфора в соединениях: PH3; H3PO4; Na4P2O7; Mg3P2; NaH2PO3.
96. Какое строение электронных слоёв у элементов подгруппы хрома при степени их окисления +3? Как
Дата добавления: 2014-10-14; просмотров: 728; Нарушение авторских прав

Мы поможем в написании ваших работ!