
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Функции белков. 1. Структурная. Из белков построен внутренний скелет клеток – цитоскелет
1. Структурная. Из белков построен внутренний скелет клеток – цитоскелет. Также они входят в состав всех клеточных органелл, мембран. В межклеточном веществе человека и животных структурную функцию выполняют белки коллаген и эластин. От содержания и расположения волокон этих белков в значительной мере зависят механические свойства тканей (твердость эластичность, упругость и т. п.). Белок кератин образует ногти, рога, копыта, клювы, волосы, иглы и т. п. Основой шелковых нитей и паутины служит белок фиброин.
2. Запасающая и энергетическая. Так называемые резервные белки запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных.
3. Каталитическая. Почти все биологические катализаторы – ферменты –являются белками (подробнее см. ниже).
4. Рецепторная. Обусловлена способностью воспринимать некоторыми белками различные химические и физические раздражители и посредством изменения формы своих молекул передавать их другим клеточным компонентам, которые вырабатывают тот или иной ответ. Этим обусловлено одно из основных свойств живого – раздражимость.
5. Регуляторная и сигнальная. Регуляторные белки регулируют активность различных внутриклеточных биохимических процессов, в том числе и синтез других белков. Они запускают и останавливают различные системы клетки по мере необходимости. Сигнальные белки осуществляют координаторную функцию на межклеточном уровне: обеспечивают передачу определенных химических (гуморальных) сигналов от одних клеток к другим. Белковую природу имеют некоторые гормоны, нейрогормоны, цитокины, факторы роста и др.
6. Транспортная. Гемоглобин разносит от легких по тканям кислород и в обратном направлении – углекислоту. Транспортные белки переносят липиды, синтезирующиеся на мембранах эндоплазматической сети, к другим органеллам. Белки, встроенные в плазматическую мембрану, обеспечивают транспорт веществ в клетку и из клетки наружу.
7. Двигательная. Моторные белки обеспечивают движения организма, перемещение клеток внутри организма (например, амебоидное движение лейкоцитов), движение ресничек и жгутиков, а также активный и направленный внутриклеточный транспорт. Например, белки актин и миозин, входящие в состав мышечных клеток, обеспечивают их способность к сокращению.
8. Защитная функция белков многообразна. Структуры, в состав которых входят белки (наружный скелет членистоногих, кости, хрящевые образования), предотвращают повреждение тканей и органов. Белки защищают организмы от проникновения извне чужеродных веществ и болезнетворных микроорганизмов. Иммуноглобулины (или антитела) позвоночных животных – специализированные белки, способные распознать и обезвредить бактерии, вирусы, другие посторонние для организма структуры и вещества – антигены, воспринимаемые им как инородные. Они вызывают специфический иммунный ответ. Иммуноглобулинам присуща специфичность – определенное антитело образуется в ответ на поступление в организм того или иного антигена. Интерферон – это белок, который подавляет жизнедеятельность и размножение вирусов. Белки крови участвуют в процессах ее свертывания и образования тромбов, предотвращая кровопотери при повреждении стенок кровеносных сосудов. Защитную функцию могут выполнять некоторые ферменты, например лизоцим, который содержится в слюне, слизистых оболочках, слезной жидкости и обезвреживает различные болезнетворные агенты.
Подводя итоги вышесказанного, можно констатировать, что роль белков для живых организмов невозможно переоценить. Не случайно Энгельс определил жизнь как способ существования белковых тел.
IV. Ферменты – это биологические катализаторы.
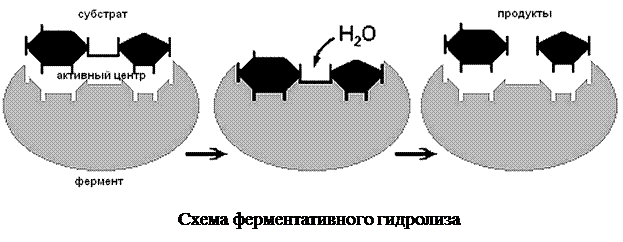
Катализ – изменение скорости протекания химических реакций под действием определенных химических соединений. С участием фермента реакция осуществляется в 106–1012 раз быстрее, чем в среде без фермента. Чтобы в приемлемые сроки состоялась реакция без участия ферментов, нужны высокая концентрация реагирующих веществ в среде или повышенная температура, при которой ускоряется движение молекул и возрастает вероятность контактов молекул реагирующих соединений. Но в организмах концентрация веществ часто очень низкая, а высокие температуры для них опасны. Именно поэтому биохимические реакции не могут происходить без участия ферментов. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами.
Ферменты бывают простыми и сложными. Простые ферменты – это белковые молекулы, состоящие лишь из аминокислотных остатков (пепсин, трипсин и т. п.). Сложные ферменты, кроме белковой части, содержат еще и небелковую, которую называют кофактором. Кофакторами могут быть неорганические катионы или анионы. Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами. Белковый компонент определяет, какую именно реакцию катализирует данный сложный фермент. Активность сложных ферментов проявляется лишь тогда, когда их белковая и небелковая части соединены.
Каталитическая активность фермента определена не всей его молекулой, а лишь ее небольшим участком – активным центром. Его пространственная структура отвечает химическому строению субстрата. Именно поэтому действие фермента специфично. В одной молекуле фермента может быть несколько активных центров.
Ферменты образуют неустойчивые комплексы с субстратами. При контакте с ферментом субстрат, вступающее в реакцию, располагается в непосредственной близости к специфическим группам его активного центра. При этом уменьшается стабильность химических связей в молекуле субстрата. Известно, что для начала химической реакции необходима определенная энергия, названная энергией активации. Образовавшийся комплекс «фермент – субстрат» снижает энергию активации. Такой комплекс быстро распадается с образованием продуктов реакции. Сам фермент при этом не теряет своей активности и может катализировать следующую подобную реакцию.
Одни ферменты обеспечивают расщепление, другие – синтез определенных веществ. Например, фермент обеспечивает расщепление (гидролиз) целлюлозы, амилаза – гидролиз крахмала.
Активность фермента проявляется лишь в определенных условиях (температура, давление, рН и т. п.). Существуют также вещества, способные снижать активность ферментов – ингибиторы.
 Ферментативные реакции происходят в виде ряда (до нескольких десятков) последовательных этапов, каждый из которых катализируется определенным ферментом. Цепи взаимосвязанных ферментативных реакций обеспечивают обмен веществ и превращение энергии в отдельных клетках и организме в целом.
Ферментативные реакции происходят в виде ряда (до нескольких десятков) последовательных этапов, каждый из которых катализируется определенным ферментом. Цепи взаимосвязанных ферментативных реакций обеспечивают обмен веществ и превращение энергии в отдельных клетках и организме в целом.
Литература:
Балан П.Г. Биология: Учебн. для общеобразоват. учебн. заведений: уровень стандарта, академический уровень / П.Г.Балан, Ю.Г.Верес,В.П.АПолищук; пер. с укр. – к,:Генеза, 2010. С. 41-58.
| <== предыдущая страница | | | следующая страница ==> |
| Структурные уровни организации белков | | | Определение. Преподаватель Наталья Нефедова |
Дата добавления: 2014-12-09; просмотров: 307; Нарушение авторских прав

Мы поможем в написании ваших работ!