
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лабораторная работа №6. Метод титриметрического анализа: редоксиметрия, метод перманганатометрии
АНАЛИЗ СУЛЬФИТА НАТРИЯ В ТЕХНИЧЕСКОМ ОБРАЗЦЕ СУЛЬФИТА НАТРИЯNa2SO3.
Метод титриметрического анализа: редоксиметрия, метод перманганатометрии.
Тип титрования: реверсивное титрование.
Цель работы: Познакомиться с методикой определения массовой доли сульфита натрия в техническом образце
Задача:
1.Определить массовой доли сульфита натрия в техническом образцеNa2SO3 перманганатометрическим методом анализа по прилагающейся методике.
2. По результатам титрованиярассчитать массовую долю (%) Na2SO3 в анализируемом образце сульфите натрия.
Чтобы избежать потери при разложении Na2SO3 в кислой среде применяют реверсивное титрование (обратный порядок титрования).
При выполнении реверсивного титрования в методе перманганатометрии, чтобы не потерять сульфит натрия (анализируемое вещество) выполняют титрование наоборот: стандартный раствор метода перманганатометрии KMnO4 и среду (H2SO4 серную кислоту) помещают в коническую (титровальную колбу), а анализируемым раствором заполняют бюретку.
Требования техники безопасности при выполнении работы:
1. Необходимо соблюдать свое рабочее место в чистоте и порядке.
2. При выполнении работы рационально использовать рабочее время.
3. Необходимо соблюдать правила работы со стеклянной посудой.
4. Аликвоту раствора следует отбирать нагнетателем или грушей.
5. Необходимо соблюдать правила техники безопасности при работе с электрооборудованием.
6. ПОМНИ! В промывалке может быть не только дистиллированная вода, но и раствор кислоты или щелочи.
7. В весовой комнате производят взвешивание только химически чистых веществ (для приготовления стандартных растворов) или образцы для анализа.
8. Принимать пищу в лаборатории запрещается.
9. По окончании работы необходимо убрать за собой рабочее место
1.Химическая сущность определения:
5Na2SO3+2KMnO4+3H2SO4= 2MnSO4+5NaSO4+ K2SO4+3H2O
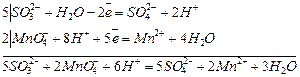
Мэ (KMnO4) = М/5 = 31,61 г/моль
Мэ (Na2SO3) = М/2 = 63,02 г/моль
1. Предварительные вычисления массы навески образца сульфита натрия для анализа.
Задача: Какую навеску сульфита натрия, содержащую 20% примесей, необходимо взять для приготовления 100мл (200мл) 0,05н раствора?
| Дано: w (Na2SO3) = 80% Cн (Na2SO3) =0,05 моль/л Vк = 100 мл ( 200 мл; 250 мл) Мэ (Na2SO3) = М/2 = 63,02 г/моль Мэ (KMnO4) = М/5 = 31,61 г/моль | 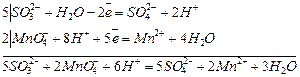
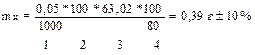
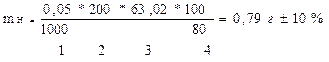 Вопросы к строчке:
1.Сколько моль-экв Na2SO3 содержится в 1,00мл раствора?
2.Сколько моль-экв Na2SO3содержится в объеме мерной колбы (100мл; 200мл)
3.Сколько г х.ч. Na2SO3содержится в объеме мерной колбы (100мл; 200мл).
4.Сколько г 80% Na2SO3 содержится в объеме мерной колбы (100мл; 200мл)?(Какова масса навески?)
Вопросы к строчке:
1.Сколько моль-экв Na2SO3 содержится в 1,00мл раствора?
2.Сколько моль-экв Na2SO3содержится в объеме мерной колбы (100мл; 200мл)
3.Сколько г х.ч. Na2SO3содержится в объеме мерной колбы (100мл; 200мл).
4.Сколько г 80% Na2SO3 содержится в объеме мерной колбы (100мл; 200мл)?(Какова масса навески?)
|
| mн-? |
| Максимальная навеска: mmax = mн (рассчитанная)+10% | Минимальная навеска: mmin= mн(рассчитанная) -10% |
| mmax =0,39 + 0,039= ….. г mmin =0,39 - 0,039 = ……..г mmax =0,79 + 0,079= ……г mmax =0,79 - 0,079= ……г Вывод: Навеска технического образца Na2SO3 взвешивается на аналитических весах с учетом ±10% от рассчитанной величины, на часовом стекле; При взвешивании навески учитывается объем мерной колбы, в которой растворяется образец сульфита натрия для анализа |
| <== предыдущая страница | | | следующая страница ==> |
| Глава 8. Духи-покровители и духи-помощники шаманов | | | Методика приготовления раствора сульфита натрия для анализа |
Дата добавления: 2015-07-26; просмотров: 253; Нарушение авторских прав

Мы поможем в написании ваших работ!