
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ТЕОРИЯ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ ДЕБАЯ И ГЮККЕЛЯ
ПРИЧИНЫ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
При растворении электролитов с ионной кристаллической решеткой дипольные молекулы растворителя сольватируют ионы вещества, ослабляют электростатическое взаимодействие между ними и отделяют ионы друг от друга. Диссоциация молекул на ионы возможна при условии, что энергия сольватации соизмерима с энергией электростатического взаимодействия между ионами. Кулоновское взаимодействие между ионами обратно пропорционально диэлектрической проницаемости растворителя. Поэтому наиболее полно электролиты диссоциируют в сильно полярных жидкостях: в воде, синильной и муравьиных кислотах (eН2О = 78,3, eНСN = 107,eHCOOH = 57); слабее диссоциируют в низших спиртах, кетонах и жидком аммиаке (eСН3ОН = 32,7,e(СН3)2О = 20,7,eNH3 = 16,9) и не диссоциируют в таких неполярных растворителях, как бензол и сероуглерод (eС6Н6 = 2,3,eCS2 = 2,6 ).
Таким образом, распад молекул на ионы обусловлен высокой диэлектрической проницаемостью среды и сольватацией.
Теория Аррениуса имела два существенных недостатка.
Первый недостаток был связан с тем, что она игнорировала взаимодействие ионов с диполями растворителя. А именно это взаимодействие является основой образования ионов в растворе при растворении электролита.
Второй недостаток связан с игнорированием ион-ионного взаимодействия.
Недостатки теории Аррениуса были преодолены в теории сильных электролитов, выдвинутой П. Гюккелем и Э. Дебаем в 1923 г., которые, принимая степень диссоциации сильных электролитов в растворе близкой к единице, учли изменение энергии раствора за счет электростатического взаимодействия ионов.
Согласно теории, каждый ион раствора рассматривается в качестве центрального иона, окруженного ионной атмосферой, имеющей шаровую симметрию и состоящей из ионов с различным знаком заряда. По мере разбавления раствора расстояния между ионами увеличиваются и силы электростатического взаимодействия ослабевают. Каждый ион в таком разбавленном состоянии не зависит от другого.
Количественные расчеты свойств растворов сильных электролитов строятся в настоящее время на введение понятий активности электролита и активности его ионов. Активность равна произведению концентрации на коэффициент активности. Определить непосредственно коэффициенты активности катионов и анионов в отдельности не прeдставляется возможным, так как в растворе одновременно содержатся те и другие ионы. Поэтому измеряют средние коэффициенты активности электролита как среднюю геометрическую величину
g± = 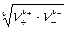 ,
,
а для бинарного электролита
g± = 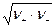 .
.
Аналогично получают среднюю ионную активность
a± = 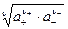 ,
,
и среднюю ионную моляльность
m± = 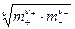 ,
,
откуда a± = g±×m±.
Важной характеристикой растворов сильных электролитов является ионная сила раствора, представляющая собою полусумму произведения концентраций ионов на квадраты их заряда:
I =(m1z12 + m2z22 +....+mi zi2).
Зависимость коэффициента активности от ионной силы была установлена Гюккелем и Дебаем
lgg± = -1,283×106 1/n ånizi2(eT)-3/2√I,
а для водных бинарных растворов при 25°С:
lg g± = -0,051│z+ z-│ I1/2.
| <== предыдущая страница | | | следующая страница ==> |
| ОСНОВЫ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ | | | УДЕЛЬНАЯ И ЭКВИВАЛЕНТНАЯ ЭЛЕКТРОПРОВОДНОСТИ |
Дата добавления: 2014-03-11; просмотров: 510; Нарушение авторских прав

Мы поможем в написании ваших работ!