
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Основные понятия. Раствор – гомогенная система, состоящая из двух и более компонентов: растворитель и растворенное вещество (вещества)
РАСТВОРЫ
Раствор – гомогенная система, состоящая из двух и более компонентов: растворитель и растворенное вещество (вещества). Растворы могут быть газовые, жидкие, твердые. В этом курсе химии ограничимся рассмотрением жидких растворов.
Важнейшей характеристикой любого раствора является концентрация. Концентрация показывает содержание растворенного вещества в единице массы или объема раствора или растворителя. Рассмотрим основные способы выражения концентрации растворов.
Процентное содержание растворенного вещества (С) - отношение массы растворенного вещества к общей массе раствора, выраженное в процентах:
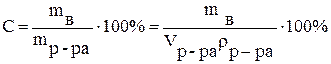 ,
,
где 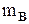 - масса растворенного вещества, г;
- масса растворенного вещества, г;
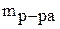 - масса раствора, г;
- масса раствора, г;
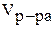 - объем раствора, мл;
- объем раствора, мл;
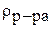 - плотность раствора, г/мл.
- плотность раствора, г/мл.
Молярная концентрация (См) – отношение количества растворённого вещества к объёму раствора, выраженному в литрах:

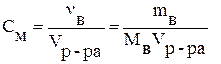 ,
,
где  - молярная масса растворенного вещества, г/ моль;
- молярная масса растворенного вещества, г/ моль;
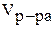 - объем раствора, л.
- объем раствора, л.
Размерность молярной концентрации - моль/л.
· Пример. Вычислите процентную и молярную концентрации раствора H3PO4, содержащего 18 г кислоты в 282 мл воды, если плотность его равна 1,03 г/мл.
Решение
Рассчитываем процентную концентрацию (следует помнить что плотность воды 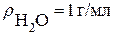 ):
):
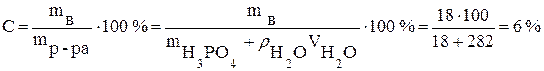 .
.
Чтобы рассчитать молярную концентрацию раствора, выражаем массу растворённого вещества из формулы для процентной концентрации:
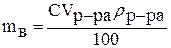 ,
,
а затем полученное выражение подставляем в формулу для молярной концентрации:
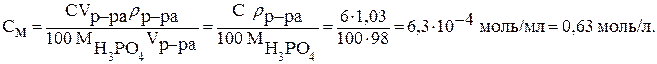
| <== предыдущая страница | | | следующая страница ==> |
| Принцип Ле Шателье | | | Растворы электролитов. Электролитическая диссоциация |
Дата добавления: 2014-02-27; просмотров: 352; Нарушение авторских прав

Мы поможем в написании ваших работ!