
Химические свойства.
Date: 2015-10-07; view: 633.
| Кислородсодержащие | Бескислородные |
| 1.Изменяют окраску индикаторов | |
| лакмус-красный, метилоранж-красный ( только для растворимых кислот) | |
| 2.Взаимодействие с металлами, стоящими до водорода | |
H2SO4+Ca=CaSO4+H2 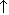
| 2HCl+Ca=CaCl2+H2 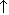
|
| 2.Взаимодействие с основными оксидами | |
| H2SO4+CaO=CaSO4+H2O | 2HCl+CaO=CaCl2+H2O |
| 3.Взаимодействие с основаниями | |
| H2SO4+Ca(OH)2=CaSO4+2H2O | 2HCl+Ca(OH)2=CaCl2+2H2O |
| 4.Взаимодействие с амфотерными оксидами | |
| H2SO4+ZnO=ZnSO4+H2O | 2HCl+ZnO=ZnCl2+H2O |
| 5.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество | |
| H2SO4+BaCl2=BaSO4+2HCl | 2HCl+Na2CO3=2NaCl+H2O+CO2 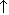
|
| 6.При нагревании | |
| Слабые кислоты легко разлагаются H2SiO3=H2O+SiO2 | H2S=H2+S |
3.
Основания - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами-ОН. Общая формула:
 Получение оснований.
Получение оснований.
| Щелочи | 1.Металл+вода | 2Na+H2O=2NaOH+H2 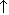 Ba+2H2O=Ba(OH)2+H2 Ba+2H2O=Ba(OH)2+H2 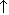
|
| 2.Оксид+вода | Li2O+H2O=2LiOH CaO+H2O=Ca(OH)2 | |
| 3.Электролиз растворов щелочных металлов | 2NaCl+2H2O=2NaOH+Cl2+H2 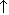
| |
| Нерастворимые основания | Соль+щелочь | CuSO4+2NaOH=Cu(OH)2+Na2SO4 |
| <== previous lecture | | | next lecture ==> |
| Получение кислот. | | | Получение солей. |