
Получение солей.
Date: 2015-10-07; view: 549.
Химические свойства оснований.
| Щёлочи | Нерастворимые основания |
| 1.Взаимодействие с кислотами | |
| KOH+HCl=KCl+H2O | Cu(OH)2+2HCl=CuCl2+2H2O |
| 2.Взаимодействие с кислотными оксидами | |
| 2KOH+CO2=K2CO3+H2O | не характерны |
| 3.Действие индикаторов | |
| лакмус-синяя, фенолфталеин-малиновая | окраска не изменяется |
| 4.Взаимодействие с амфотерными оксидами | |
| 2KOH+ZnO=K2ZnO2+H2O | не реагируют |
| 5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание | |
| NaOH+CuCl2=Cu(OH)2=2NaCl | не реагируют |
| 6.При нагревании | |
| не разлагаются(кроме LiOH) | Cu(OH)2=CuO+H2O |
| Амфотерные гидроксиды( Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3 и другие. | |
| Взаимодействуют с кислотами Zn(OH)2+2HCl=ZnCl2+2H2O | Взаимодействуют с щелочами Al(OH)3+NaOH=Na[Al(OH)4] |
4. Соли - сложные вещества, состоящие из атомов металлов металлов (иногда входит водород) и кислотных остатков.
| 1.С использованием металлов | металл+неметалл | Mg+Cl2=MgCl2 |
| металл+кислота | Zn+2HCl=ZnCI2+H2 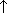
| |
| металл+соль | Fe+CuSO4=FeSO4+Cu | |
| 2.С использованием оксидов | основной оксид+кислота | CaO+2HCl=CaCl2+H2O |
| кислотный оксид+основание | CO2+Ca(OH)2=CaCO3 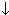 +H2O +H2O
| |
| кислотный+основной оксиды | CaO+CO2=CaCO3 | |
| основной+амфотерный оксиды | Al2O3+CaO=Ca(AlO2)2 | |
| 3.Реакция нейтрализации | кислота+основание | H2SO4+2NaOH=Na2SO4+2H2O |
| 4.Из солей | соль+соль | AgNO3+NaCl=AgCl 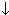 +NaNO3 +NaNO3
|
| соль+щелочь | CuSO4+2NaOH=Cu(OH)2 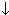 +Na2SO4 +Na2SO4
| |
| соль+кислота | Na2CO3+2HCl=2NaCl+H2O+CO2 
| |
| Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях(при избытке кислоты) | ||
| NaOH+H2SO4=NaHSO4+H2O | ||
| Основные соли образуются при взаимодействии некоторых солей со щелочами (при избытке щелочи) | ||
ZnCl2+NaOH=ZnOHCl  +NaCl +NaCl
|
| <== previous lecture | | | next lecture ==> |
| Химические свойства. | | | Химические свойства солей. |