
Химические свойства солей.
Date: 2015-10-07; view: 581.
| Разложение при прокаливании | CaCO3=CaO+CO2 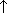
|
| Cоль+металл | Fe+CuSO4=FeSO4+Cu |
| Соль+соль | AgNO3+NaCl=AgCl 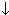 +NaNO3 +NaNO3
|
| Соль+щелочь | CuSO4+2NaOH=Cu(OH)2 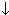 +Na2SO4 +Na2SO4
|
| Соль+кислота | Na2CO3+2HCl=2NaCl+H2O+CO2 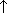
|
5. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ.
Химические реакции по количеству исходных веществ и продуктов реакции можно разделить на группы:
| Тип химической реакции | Определение | Пример |
| Соединения | Реакции между двумя простыми веществами, или между несколькими сложными, при этом образуется одно сложное или более сложное вещество. | CaO+H2O=Ca(OH)2 PbO+SiO2=PbSiO3 2Na+Cl2=2NaCl |
| Разложения | Реакции, при которых из одного вещества образуется несколько простых или сложных веществ. | Cu(OH)2=CuO+H2O CaCO3=CaO+CO2 NH4Cl=NH3+HCl |
| Замещения | Реакции между сложным и простым веществами, при которых атомы простого вещества замещают один из атомов сложного | CuSO4+Fe=FeSO4+Cu 2KBr+Cl2=2KCl+Br2 |
| Обмена | Реакции между двумя сложными веществами, при которых они обмениваются своими составными частями | AgNO3+KBr=AgBr  NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
|
6. Основные положения атомно-молекулярного учения о строении вещества.
1. В основе учения о строении вещества лежит принцип дискретности, т. е. вещество не является сплошным, а состоит из отдельных мельчайших частиц (атомы, молекулы или ионы).
Молекула – это наименьшая нейтральная частица вещества, состоящая из атомов и являющаяся носителем его химических свойств.
Атом – это наименьшая нейтральная частица химического элемента, состоящая из элементарных частиц, обладающая его химическими свойствами.
Химический элемент – это вид атомов, характеризующийся определённой величиной положительного заряда ядра и совокупностью свойств.
2. При соединении друг с другом атомов одного и того же химического элемента образуются простые вещества. Если соединяются атомы разных элементов, образуются сложные вещества.
Химические элементы: H, O, N.
Простые вещества: H2, O2, O3, N2.
Сложные вещества: H2O, NH3, HNO3.
3. Атомы и молекулы в веществе находятся в постоянном движении, характер которого зависит от агрегатного состояния вещества. Чем выше температура, тем интенсивнее движение частиц.
4. В состав молекул может входить различное число атомов. Молекулы инертных газов состоят из одного атома: He, Ar. Молекулы простых газов состоят из двух, реже трёх атомов: Н2, N2, O3. В состав молекулы серной кислоты H2SO4 входит 7 атомов, молекулы многих полимерных веществ насчитывают сотни и тысячи атомов: [-CH2-CH2-]n.
5. Образуя молекулы, атомы могут соединяться друг с другом не только в различных количествах, но и разным образом в пространстве, увеличивая тем самым многообразие веществ (явление получило название «изомерия» и наиболее распространено среди органических веществ).
|
| ||||
| |||||
6. Существуют вещества, в которых носителями свойств являются не молекулы, а атомы (атомные кристаллы, металлы), ионы (растворы солей, кислот и т. д.) или их комбинации.
Окончательному утверждению атомно-молекулярного учения в химии способствовало развитие количественных методов анализа химических веществ и открытие стехиометрических (количественных) законов.
7. Основные законы химии
Закон сохранения массы (М. Ломоносов, 1748; А. Лавуазье, 1789): масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Периодический закон (Д. Менделеев, 1869): свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра элемента. Существует ряд частных законов химии, которые имеют ограниченную область применения.
Закон постоянства состава (Ж. Пруст, 1808): все индивидуальные вещества имеют постоянный качественный и количественный состав, независимо от способа их получения. Известны соединения переменного состава, для которых закон Пруста несправедлив, например сверхпроводники общей формулы: YBa2Cu307-x.
Решающую роль в доказательстве существования атомов и молекул сыграли газовые законы.
Закон объемных отношений (Ж. Гей-Люс-сак, 1808): объемы газов, вступающих в реакцию, а также объемы газообразных продуктов реакции, относятся друг к другу как небольшие целые числа.
Закон Авогадро - в равных объемах любых газов при постоянных температуре и давлении содержится одинаковое число молекул. Закон Авогадро является следствием уравнения Клапейрона - Менделеева: pV = nRT или pV = (m/M)RT, где p - давление газа, V - его объем, n - количество газа (в молях), R - универсальная газовая постоянная, Т - абсолютная температура, m - масса газа, М - его молярная масса.
Численное значение R зависит от размерности давления (объем газов, как правило, выражают в литрах). Если [p] = кПа, то R = 8,314 Дж/(моль*К); если [p] = атм, то R = 0,082 л*атм/(моль*К).
Нормативные условия для газов: Р0 = 101,325 кПа - 1 атм, Т0 = 273,15 К = 0°С. При нормальных условиях объем одного моля газа равен:
Vm = RТ0/p0 = 22,4 л/моль.
Количество газа при нормальных условиях рассчитывают по формуле:
n = V/Vm = V/22,4.
При произвольных условиях количество газа рассчитывают по уравнению Клапейрона - Менделеева:
n = pV/(RT).
Плотность газов прямо пропорциональна их молярной массе при заданных давлении и температуре:
r = m/V = pM/(RT) = (p/RT)M.
Относительная плотность газов показывает, во сколько раз один газ тяжелее другого. Плотность газа В по газу А определяется следующим образом:
DA(B) = r(В)/r(А) = М(В)/М(А).
Средняя молярная масса смеси x газов равна общей массе смеси, деленной на общее число молей:
Мср = (m1 + m2 + ... + mx)/(n1 + n2 + ... + nx).
8.В 1869 году Д.И.Менделеев на основе данных накопленных о химических элементах сформулировал свой периодический закон. Тогда он звучал так: « Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных масс элементов». Очень долго физический смысл закона Д.И.Менделеева был непонятен. Всё встало на свои места после открытия в XX веке строения атома.
Современная формулировка периодического закона: « Свойства простых веществ, также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома».
Заряд ядра атома равен числу протонов в ядре. Число протонов уравновешивается числом электронов в атоме. Таким образом, атом электронейтрален.
Заряд ядра атома в Периодической таблице – это порядковый номер элемента.
Номер периодапоказывает число энергетических уровней,на которых вращаются электроны.
Номер группыпоказывает число валентных электронов.Для элементов главных подгрупп число валентных электронов равно числу электронов на внешнем энергетическом уровне. Именно валентные электроны отвечают за образование химических связей элемента.
Химические элементы 8 группы – инертные газы имеют на внешней электронной оболочке 8 электронов. Такая электронная оболочка энергетически выгодна. Все атомы стремятся заполнить свою внешнюю электронную оболочку до 8 электронов.
| <== previous lecture | | | next lecture ==> |
| Получение солей. | | | Какие же характеристики атома меняются в Периодической системе периодически? |