
ДЛФО теориясы
Date: 2014-02-26; view: 2467.
О
Оксоэтиленді тізбектегі эфир тобын құрастыратын оттек атомы әлсіз болса да , сумен әрекеттесетіндіктен , олар шамалы ғана гидрофильді болады. Сол секілді оксиэтилендегі оттек атомы тек сутек молекуласымен байланысып қана қоймай , өзіндегі энтропиялық ықпал әсерінен су молекуласын өзіне тізбектей келіп , оралған жіп секілді ұстайды. Сондықтан да бұлардағы оксиэтилен тобына орай оның судағы ерігіштігі мен қасиеті тәуелді өзгереді.
Барлық ерігіш заттар сұйық ауа шекарасында адсорбтелу қабілетіне байланысты 2 топқа бөлінеді: беттік активті заттар және беттік инактивті заттар.
БАЗ-тар беттік қабатта жинала алады, нәтижесінде оң адсорбция, яғни Г>0 жүруі тиіс.
Беттік активті заттардың беттік керілуі және салыстырмалы аз ерігіштікте болуы тиіс. Егер жақсы еріген болса, беттен тереңіне шөгуге ұмтылар еді. басқаша айтқанда, БАЗ молекеулалары аз ерігіштікте болуы тиіс. Егер жақсы еріген болса, беттен тереңіне шөгуге ұмтылар еді. басқаша айтқанда, БАЗ молекулалары мен еріткіш молекулалары арасындағы өзара әсерлесу еріткіш молекулалары арасындағы өзара әсерлесуден әрқашан аз болу керек. Сондықтан БАЗ-дар ерітіндіден бөлініп бетіне шығады, яғни бұл жағдайда Г>0 нәтижесінде беттік керілу азаяды.
БАЗ-ға сумен салыстырғанда көп органикалық қосылыстар, әсіресе үлкен көмірсутекті разикалы бар май қышқылдары май қышқылдарының тұздары, сульфоқышқылдар және олардың тұздары, спирттер, аминдер жатады. БАЗ-дың молекулаларының құрылымының сипатты ерекшелігі – олардың дифильдігі, яғни молекуланың 2 бөліктен құралуы – полярлы топ және полярсыз көмірсутек радикалынан. Диполь моменті айтарлықтай мәнде және жақсы гидратталатын көмірсутек радикалы БАЗ-дың суға жақындығын туғызады. Гидрафобты көмірсутек радикалы қосылыстардың аз ерігіштігінің себебі болып табылады. БАЗ сулы ерітінділерінің ең аз беттік керілу шамасы 25 эрг/см2, яғни көмірсутектің беттік керілуіне теңеседі.
 Дифильді молекула келесі жалпы символмен белгіленеді.
Дифильді молекула келесі жалпы символмен белгіленеді.
домалақ – полярлы топ, сызық – полярсыз радикал.
Беттік инактивті заттар сұйық бетінен кетуге ұмтылады, нәтижесінде теріс адсорбция жүреді, яғни Г<0. Беттік интективті заттардың беттік ерілулерді еріткіштің беттік керілуінен жоғары болады және ерігіштігі жоғары болғандықтан сұйық бетінен көлемге кетуге ұмтылады. Басқаша айтқанда, беттік инактивті заттар молекулалары мен еріткіштің өзара әсер еріткіш молекулаларының өзара әсерлесуінен әрқашан артық, сондықтан беттік инактивті заттар көлемге өтуге тырысады.
Беттік инавтивті заттарға сумен салыстырғанда барлық бейорганикалық электролиттер – қышқылдар, сілтілер, тұздар жатады. Бұл заттардың молекулаларында гидробты бөлшек жоқ және суда. Жақсы гидратталатын иондарға ыдырайды. Бір валентті иондар үшін беттік керілудің өсуі үлкен емес.
2 валентті иондар 1 валенттілерден эффективтірек (эквимолярлы ерітінділерде).
Органикалық заттардан беттік инактивті заттарға жататындары – иондалатын заттар, оларда полярсыз бөлігі немесе өте аз. Мысалы, құмырсқа және аминсірке қышқылдары.
Сусыз ерітінділерде бейорганикалық электролиттер беттік керілуді жоғарылатады, бұл эффект көлемі еріткіш табиғаттына байланысты солайша натрий иодидін метил спиртіне қосқанда беттік керілу тез артады, этил спиртінде беттік керілу жуық шамамен 2 есе аз, молекулалық салмақтары үлкен спирттерде эффект одан да аз.
Еріткіштің беткі қабатына әсер етпейтін заттар беткі қабат пен ерітіндіде тең дәрежеде болады. Және Г = 0. Бұл заттың беттік керілуі еріткіштің беттік керілуіне жақын шамада болады. Аз активті заттарға қанттарды жатқызуға болады. Қанттар суда ерігенде судың беттік керілуі өзгермейді деуге болады. Бірақ қанттар сулы ерітінді – ауа шекарасында беттік керілуі айтарлықтай өзгертпегенмен сулы ерітінді – қатты фазасының шекарасында беттік активтілік көрсетеді.
Суретте беттік керілу изотермасы қисықтары келтірілген. Бұл қисықтар заттардың концентрациясы өзгеруімен беттік керілудің өзгерісін көрсетеді. Концентрация өскенде (1 қисық) изотерма алдымен төмен түрде сұйық ауа бөлімі БАЗ-н босап және аздаған мөлшері бетіне шығады. Содан соң изотерманың қисықсызықты бөлігі басталады. Бұл жағдайда беттің едәуір бөлігі БАЗ молекулаларымен жабылады.
Беттік инактивті заттардың ерітіндідегі концентрациясын өсіргенде изотерма көтеріледі. Бұл беттік инактивті заттың беттік керілулері үлкен болғандықтан және жақсы ергіштігіне байланысты ерітіндіге өтеді.
Беттік керілуге әсер етпейтін заттар үшін концентрацияны көтергенде изотерма концентрация өсіне паралель түзу болады.
Сонымен заттардың беттік активтігі тек табиғатына ғана емес, еріткіш қасиетіне де байланысты. Егер еріткіштің беттік керілуі үлкен болса, зат едәуір беттік активтік көрсетеді, ал егер еріткіштің беттік керілуі аз болса, зат беттік инактивтік қасиет көрсетеді. Судың керілуі жоғары болатын көптеген заттар беттік активтік көрсетеді. Спирттердің беттік керілуі суға қарағанда аз. Сондықтан суда ерігенде беттік активтік көрсететін кейбір заттар, спиртте беттік инактивтік көрсетеді.
Беттік керілудің температураға байланыстылығы П.А.Рябиндер зерттеген БАЗ ерітіндінің температураға байланыстылығын алсақ болады. Заттардың беттік керілуі температурамен монотонды түрде өзгереді. Кейбір БАЗ ерітінділерінің беттік керілуі температура өсуімен максимумды қисықпен өзгере алады.
Бақылау сұрақтары:
- Беттік активті заттар туралы түсінік
- Катион активті заттар
- Анион активті заттар
- БАЗ ерітінділерін тұрмыста қолданылуы
- Ионсыз немесе ионды емес БАЗ
Дәріс № Коллоидты epітінділердің тұрақтылығы
Коллоидты жүйелердің тұрақтылық түрлері
Дәрістің мақсаты:Студенттерге коллоидты ерітінділердің тұрақтылығы және оның түрлерімен таныстыру.
Дәрістің жоспары:
1. Коллоидты ерітіңділердің тұрақтылығы
2. Коллоидты жүйелердің тұрақтылық түрлері
3. Кинетикалық және седиментациялық тұрақтылық
4. Агрегативті тұрақтылық
5. Коллоидты ерiтiндiлерге электролит әсері.
Коллоидты ерiтiндiлердiң тұрақтылығына олардың өз диcпеpcтiлiгiн, құрылымын, күйiн yaқыт бойынша өзrертпей бiр қалыпты сақтауы жатады.
Кәдiмгi ерiтiндiлерге қарағанда коллоидты ерiтiндiлердегi еpiген бөлшектер iрiлеу болып келетіндігі белгiлi. Ендеше, бұлардың ayыpлық күшi әсерінен тұнбаға шөкпеуiне нендей күш себепшi болып отыр.
Mіне, бұл cұpaққа , ғалым Н.П.Песков (1920), Мына түсініктемелер жасады
Коллоидты ерiтiндiлердiң тұpaқтылығына басты әсер ететін екі күш бар. Олардың бiрi еpiген бөлшектердiң ерiтiндi бойында бағыт-бағдарсыз броундық, қозғалысы. Бұл кинетикалық немесе седиментациялық тұpaқтылық деп аталады.
Екінші коллоидты бөлшектердiң өз құpылымы, диспepcтiлiгiн өзгертпей сақтауы. Бұл құрылымдық немесе aгpегативтi тұрақтылық деп aтaйaды.
Aгpегативтi тұрақтылыққа не коллоидты ерiтiндiлердi термодинамикалық тұрақты және термодинамикалық тұрғыда тұрақсыз деп екі түрге бөлeдi.
Темодинамикалық тұрақтылық коллоидты еpiтiнділер лиофильдi зольдер деп аталынып, олардың коллоидты бөлшектері еріткіш бойына сырттан күш жұмсамай ақ көшеді. Мысалы, шaйыpлар, майлар т.б. заттар.
Атaлған зольдер түзiлy барысында Гиббс энергияcының өзгеріс шамасы теpic мәнге ие, яғни ∆G < о. Сондықтан, мұндай жүйелерді термодинамикалық тұрақты лиофильдi зoльдер қатарына жатқызады. Ал бiз, сырттан күш жұмсап, өзiмiз ұнтақтап немесе iрiлендiрiп алатын коллоидты жүйелерімізде ∆G > о болғандықтан, oлaр термодинамикалық тұpғыдa тұpaқсыз лиофобты зольдер тобына жатқызылады. Соңғы атaлған жүйелерге өз күйiн сақтап қалатындай тұpaқтылық беру үшiн, түрлi iс-шаралар жүзеге асырылады. Коллоидты ерiтiндiлердегi бөлшектөр өз құрылымын сақтап aгpегативтi тұрақтылыққа ие болу үшiн мына факторларға баса назар аударылады.
1. Термодинамикалық факторлар:
1.1. Коллоидты бөлшектiң бетiнде электр зарядының болуы;
1.2. Коллоидты бөлшектердiң адсорбциялық – сольваттық қабатпен қаnталуы;
1.3. Бөлшектердiң ретсiз броундық қозғалысқа ұмтылуы- энтропиялық фактор.
2. Кинетикалық факторлар:
2.1. Жүйе тұтқырлығын өзгерту арқылы дисперстi фаза және дисперсионды
орта тығыздығын реттейтін гидродинамикалық әсерді ескеру;
2.2. Коллоидты бөлшек бетiне арнайы беттiк белсенділікке ие (поверхностное активные) зат молекулалары apқылы серпiмдiлiкке және механикалық беріктілікке ие қорғауыш қабаттар түзiлyiн ескеру.
Бiр қapaғанда 1.2 және 2.2 әсерлерi ұқсас көрінуі мүмкін.
Агрегативтi тұpaқтылық беретiн 1.2 - әcеp коллоидты бөлшекке адсорбциаланған иондардың ерiткiш молекулаларымен сольваттануы арқылы түзілетін қабат. Ал 2.2 түрдегi әсер сырттан коллоидты жүйеге қосымша қосылатын беттiк белсенділікке ие заттар, яғни стабилизаторлар қосу apқылы қоpғауыш қабатының түзiлyi.
Мысалы, кремний диоксидiнiң зольiн тұpaқтaндыpy үшiн желатина ерітіндісін қосады. Коллоидты бөлшектер бетi - coңғы зат түзeтiн қабықшамен қапталады. Бұл қабықшалар қалындығы 1 нм, яғни мономолекулалық қалыңдыққа сәйкес келедi. Осындай түрдегi қабықшалар коллоидты бөлшектердiң бiр-бiрiне қосылып кетпeyiне себепшi болады.
Р.3игмонди деген ғaлым осы тaқылеттес заттардың коллоидты бөлшектердi қабықша түзiп қopғауын санды тұрғыда сипаттау үшiн "алтын саны" деген көрсеткiш енгiздi.
Aлтын ұнтағынан түзілген коллоидты ерітіндінің түсі қызғылт болып келедi. Коллоидты жүйеде аздaған өзгерiс болса әлгi золь лезде ауа көк түске боялады, яғни өте сезiмтал.
Міне осындай қорғауыш қабат түзетiн қасиетке ие заттардың зольдердi қopғay қабiлетiн aнықтауға алтын ұнтағынан түзiлген золь пайдаланады.
Алтынның қызыл түсті 10 мл зольіне 1 мл 10% ас тұзы ерiтiндiciн құйғанда, oны ұйытпай, яғни ауа көк түске өткізбей қоpғaп тұратын, қоpғауыш қабат (пленка) түзетiн заттың ең аз шамасы (мг) сол заттың алтын саны деп аталады.
Алтын санының шамасы неғұрлым аз болғaн сайын, ол зат coғұрлым жақсы қоpғауыш қабілетке ие екендігін көрсетедi. Атaлған заттар қатарына крахмал, гемоглобин желатина сияқты көптеген дүниеліктер жатады.
Мысалы, желатинаның алтын саны 0,01 мr -ғa тең болса, крахмал үшiн бұл көрсеткiш 20 -га теңеледі.
Коллоидты ерiтiндiлердiң өз тұpaқтылығын сақтауында қоpғауыш заттардың алар орны ерекше. Мысалы, адам бойындағы қан құрамында нашар еритiн кальций фосфаты, карбонатты коллоидты бөлшектер түрiнде ұшырасады. Осы
сияқты бөлшектердiң сырты белоктық немесе осы тұpғыдағы заттармен қапталып келедi. Кейбiр науқасқа шалдыққан кезде адам қанының құрамында қорғауыш қабықша түзетiн заттар азаяды да, әлгiдей тұздар өзара бiрiгiп тұнбаға шөгеді. Осының салдарынан буын-буында, бүйректе, бауырда тас тәрiздес шөгінділер пайда бодады. Көп жағдайларда қолданыс табатын-колларгон, протаргол сияқты дәрi-дәрмектердің қорғауыш қабат түзетiн қасиеттерi бар.
Сонымен, коллоидты ерiтiндiлердiң өз куйiн сол қалпында caқтayын сипаттайтын көрсеткіштер қатарына олардың кинетuкалық және агрегативті немесе құрылымдық тұрақтылықтары жатады.
Аталған көрсеткiштердiң өзара, кейде бiр-бiрiне қарсы әсері барын да ескерген жөн.
Мысалы, кез-келген сұйыққа жылу түрінде энергия берiлсе, ол осы жүйе бөлшектерінің қозғалысын арттырады, яғни температурасын жoғарылатады. Қозғалыс артуы нәтижесiнде бөлшектердiң өзара coқтығысуы жиiлейдi. Өзара coқтығысқан бөлшектер қосылып, iрiленуi ықтимал. Соңғы жағдай бөлшектердің құрылымы өзгергенiн, яғни агрегативтi тұрақтылықтың төмендегеніне сәйкес келедi. Ірiленген бөлшектер ауырлық күшiнiң әсерінен ыдыс түбiне шөге бастайды.
Көптеген коллоидты ерiтiндiлердiң қыздыру барысында лайланып тұрақсыз күйге көшетіндігін жиi ұшырастыруға болады.
Коллоидты ерітінділердің кинетикалық тұрактылығы
Физика курсынан мынадай жайттар белгілі. Егер, тұтқырлығы η- га тең сұйық бойында радиусы r - ге тең шар тәрiздес бөлшектер ерiтiлген болса, онда oлар өз ауырлық күшiнiң әсерінен, шөгу барысында, сұйық бойынан F -ке тең қарсы кедергі күшін сезінеді, яғни:
Ғ= 6 π rηЭ
Агрегативтi немесе құрылымдық тұрақтылық
Коллоидты ерiтiндiлер тұрақтылығын сипаттауда жоғарыда атап өткенiмiздей, ерiтiлген зат бөлшектерiнiң iрiлi - ұcaқтығы, яғни дисперстiлiгi, басты көрсеткiш болып табылатындығына көз жеткiздiк.
Epiтінді бойындағы бөлшектердiң өзара соқтығысу барысында бiрiгiп, iрiленiп дисперстiлiктi өзгертуi – коллоидты жүйенiң агрегативтiк тұрақтылығының кемігендігін айғақтайды. Коллоидты бөлшектер өзара бiрiгуi үшiн мицелла құрамындағы "коллоидты бөлшек" немесе "гранула"
потенциaлы нольге теңелуi тиiс. Бұл потенциал - дзета потенциал немесе электрокинетикалық потенциал eкендігі белгiлi. Демек, коллоидты бөлшектерге агрегативтi тұрақтылық беретiн күш төркiнiнiң бiрi оның дзета потенциалының болуы. Аталған шама нольге теңелгенде, яғни изоэлектрлiк жағдай кезiнде бөлшектер бiр-бiрiне мейлiнше жақындап бiрiге алады деп қабылданады. Алайда, кейде дзетта потенциал нольге теңелгенiмен, коллоидты жүйелер өз тұрақтылығын сақтап қалған жағдайлар жиi ұшырасады. Бұл құбылысты оқымыстылар агрегат пен ядроға тартылған
иондардың сольваттану қабатын түзумен байланыстырады.
Коллоидты бөлшек бойындағы қoc иондық қабаттың сығылуы- оның сольваттану дәрежесiнiң кемуіне әкелiп соқтырады. Сольваттанған иондар шамасының кемуі сольваттану қабатын да жұқартады.
Ал сольваттану қабаты коллоидты ерiтiндiлер тұpaқтылығын анықтауда басты көрсеткiштерiнiң бiрi болып саналатынын мына шамалардан аңғаруға болады.
Тұрақтылығы жоғары зольдерде сольваттық қабат қалыңдығы - lO-8 м және одан жоғары. Дзета потенциалы нольге тең коллоидты бөлшектерде сольваттық қабат қалыңдығы - lO-8 м -ғана және бұл жүйелер ылғи да тұрақсыз болып келедi.
Сонымен, коллоидты жүйелерге құрылымдық немесе агрегативтi тұрақтылыққа негiз болатын күштер қaтapына олардың дзета потенциалы және сольваттық қабатының болуы жатқызылады.
Коллоuдты ерiтiндi бөлшектерiнің құрылымын өзгертiп, өзара бiрiгiп, iрiленуi нәтuжесiнде тұнбаға көшуi - олардың коагуляциясы ұюы деп аталады.
Ерiтiлген бөлшектер сұйық күйiнде болып, олар сұйық бойында бiрiгiп, iрiленсе - коалесценцuя деп аталынады.
Коллоидты ерiтiндiлерге электролит әсері.
Коллоидты ерiтiндiлердiң жай - күйiне сырттан қосылған электролиттер қатты әсер етедi. Қосылған электролиттер коллоидты бөлшектердiң құрылымын өзгертiп, олардың каогуляциялануына, бір-бірімен бірігіп тұнбаға көшуіне итермелейді. Міне, осындай өзгерістер орын алу барысында тәжірибе жүзінде жинақталған тұжырым – ережелермен танысалық.
1. Кез-келген электролитті коллоидты ерітінді құрамына қосқан кезде коллоидты бөлшектердің құрамына әсер етеді.
Коллоидты ерітіндідегі бөлшектердің құрылымын өзгертіп, оның коагуляциялануына қажетті электролиттің ең аз концентрациясы ұйытудың шекті мәні немесе ұйыту шегі деп те атайды. Орыс тіліндегі порог коагуляции ұғымын құбылыстың мән мазмұнын ескере отырып ұйытудың шекті мәні немесе ұйыту шегі деп баламалы түрде аудардық. Кейбір оқулықтарда ұйыту табалдырығы деген анықтамаларда ұшырасады. Коаголяциялану, ұю бір-біріне балама ұғымдар.
Ұйытудың шекті γ, Ск – таңбаларымен белгіленеді де, ммоль/л, моль/л, моль/м3 бірліктерімен өлшенеді. Ал есептеу үшін төмендегі формуланы пайдаланады.
Vэ · С п

 γ = немесе γ =
γ = немесе γ =
V+Vэ ( V+Vэ )
Кез-келген золь ерiтiндiсiнiң уюын оның түciнің өзгеруімен, лайқаланылуымен және диспеpcтi фазаның тұнбаға көшyiнен байқауға болады.
2. 3ольдi ұйыту үшiн пайдаланылатын электролит құрамындағы ионның заряд таңбасы коллоидты бөлшектiң потенциал анықтауыш ион таңбасына қарама – қарсы болуы тиiс. Атaлған ион зарядының шамасы apтқан сайын оның ұйыту қабiлетi де артады. Бұл заңдылық Шульце-Гарди ережесі деп аталады да төмендегiше тұжырымдалады.
Ұйыту шегiнің ең кішi мәні заряды үлкен ионга сәйкес келедi және олардың арасындағы байланыс мына mеңдiкпен өрнекmеледi:
cоnst
 γ =
γ =
z 6
Мұндағы z- ион заряды
з. Шульце-Гарди ережесiне opганикалық тeктeгi иондар бағынбауы да мүмкін. Органикалық иондардың ұйыту қабiлетi олардың адсорбциялану бейiмдiлiгiнiң өcyiмен артады.
4. 3арядтары бiрдей иондар үшiн олардың гидратациялану дәрежесi кему бағытында ұйыту қабiлетi де артады.
Мысалы:
Мұндай қатарлар "лиотропты қатарлар" немесе "Гофмейстер қатары" деп аталынады.
5. Көпшiлiк зольдердiң уюы олардың дзета потенциал мәндерiнiң 30 мВ төңiрегiнде бастала бередi.
6. Ұйыту барысында электролиттер қоспасы пайдаланылса олардың әpi әртүрлi болып келедi.
- электролиттердiң ұйыту әcepi олардың ұйыту шектi мәндерiн қосу ақылы анықталады (арифметикалық қосу). Атaлған электролиттер қатарына ион зарядтары бiрдей және гидратациялану дәрежесi өзара жуық иондар жатады (КСI + КNОз. КСI + NaCl);
- электролиттер қоспасы бiр-бiрiнiң ұйыту қабiлетiн көп төмендетiп жiбередi және бұл анmогонизм әcepi деп аталады. Мысалы, күміс иодидi зольiн AI(NO3)3 + K2S04 немесе Ti (NO3)4 + Na2SO4 қоспаларымен ұйытқанда антогонизм әсеpi орын алады;
- электролиттер қоспасы бiр-бiрiнiң ұйыту қабiлетiн жеке-жеке алғандығыға қарағанда арттырады және бұл синергизм әcepi деп аталады.
7. Коллоидты бөлшектерiнiң заряд таңбалары қарама – қарсы болып келген екі золь өзара қосылғанда коагуляцияға ұшырайды.
Коллоидті ерiтiндiлердiң тұрақтылығы
Коллоидты ерiтiндiлердiң тұрақтылық теориясын дамытқан Б.В.Дерягин, Л.Д.Ландау, Э.Фервей және Я.Овербек сынды ғалымдар болды. Осы оқымыстылардың фамилияларының бас әрiпiнен, олар дaмытқан көзқарасты ДЛФО теориясы деп атайды.
Бұл көзқарас бойынша кез-келген eкi бөлшек молекула аралық әрлесу күштері нәтижeciнде тартылыста және тебiлiсте болады. Коллоидты бөлшектердiң бiр-бiрiне тартылу және тебiлу күштерiнiң шамасын олардың ара қашықтықтарын өзгеруiне байланысты есептей отырып 4.3 суреттeгiдей бейнедегi тәуелдiлiк сызығын алады.
Li + Na+ К+ Rb+
Сl Br - J- CNS-
Гидратациялану дәрежесi кемидi
Ұйыту қабілеті артады
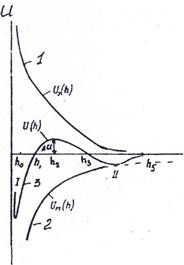
4.1 - сурет. коллоидты бөлшектердің өзара әрекеттесуінің потенциалды қисық сызықтары
1- бөлшектердiң өзара тебiсу энергиясын бейнелейтін тәуелділік;
2 - бөлшектердің өзара тартылу энергиясын бейнелейтiн тәуелділік;
3 – бөлшектердiң тебiсу және тартылу энергиясын қоса ecкepeтін тәуелдiлiк
сызығы.
Дәріс №
Дәрістің тақырыбы : Адсорбция . Адсорбциялық құбылыстың жалпысипаттамасы
Дәрістің жоспары:
1. Сорбция ұғымына жалпы түсінік
2. Адсорбция және абсорбцияның айырмашылығы
3. Капиллиялық конденсация
4. Хемосорбция
5. Адсорбцияның түрлері
Дәрістің мақсаты : адсорбция және абсорция ұғымдарының ерекшеліктерімен студенттерді таныстырып, адсорбциялық құбылыстар туралы түсінік беру.
Берілген дененің (заттың) дисперстілік дәрежесі жоғарылаған сайын, ол өзінің көбейген бетіне басқа дененің көп бөлшегін сіңіреді. Еріген немесе газ қалпындағы заттардың қатты дене немесе сұйықтың бетіне өздігінен жиналып, шоғырлана келіп, қоюлану құбылысын сорбция деп атайды. Әдетте өзіне басқаны сіңіруші затты – сорбент, ал оған сіңірілетін сорбтив деп атайды. Ал сорбцияға кері құбылысты десорбция дейді. Сорбтив бөлшектері сорбентке қаншалықты терең сіңіруіне байланысты және ондағы пайда болатын өзара әсермен байланыс күшіне, табиғатына сәйкес сорбция құбылысын қарастырады. Егер сіңіру дененің тек беткі қабатында ғана жүретін болса, онда оны адсорбция деп атайды. Мұнда да сіңіруші затты адсорбент, ал сіңірілетін затты адсорбтив деп атайды.
Сорбент пен сорбтив бөлшектерінің табиғаты мен өзара әрекеттеу сипатына орай сорбция құрылысын физикалық және химиялық деп бөледі. Физикалық сорбция әлсіз және қайтымды. Ол тек молекулаарлық, яғни ван-дер-ваальстік күш әсерімен жүзеге асады. Ал химиялық сорбцияны көбіне хемосорбция деп те атайды және ол қайтымсыз, өйткені ол артық не бос валенттілік арқылы іске асады. Хемосорбцияның өзі оған әрі жіктеле келіп, абсорбциялық және адсорбциялық болып бөлінеді. Бұл бөлулер тек шартты ғана.
Капилляр(жiңiшке түтiкше) конденсациялы сорбциялық процестер деп аталатын құбылыстың негiзгi мәні тек сiңiруде ғана емес, мысалы, активтi көмiрдiң өз бойына газдар мен буларды сiңiретiнi сияқты, жеңiлдетiлген қатты қуыс сорбенттердiң өз бойына конденсациялануымен де ерекше мәнде болады. Капиллярлы конденсация ең әуелi оңай да жеңiл қысылатын (сығылатын) газдарда жиi кездеседi.
Капиллярлық конденсация дегенiмiз қатты дене (сорбент) қуысында бу сияқты заттардың (сорбтивтердiң) конденсациялануы. Конденсация құбылысы температураға, бу серпiмдiлiгiне, капилляр диаметрiне, қатты сорбенттiң беткi қабатынын. өзiне сұйық күйдегi сорбтивтi жұқтыру қабiлетiне байланысты. Ондағы капилляр түтігі жiңiшке болған сайын жане олардың қабырғасы сұйық күйдегi сорбтивтi өзiне жақсы жұқтырғанда да конденсациялану тезiрек жүредi.
Абсорбция дегенiмiз сорбент массасына диффузия арқылы газ енгендегi сорбция құбылысы. Ол берiлген бiр заттың (сорбтивтiң) екiншi бiр затта (сорбентте) еру құбылысына пара-пар. Фаза араларындағы заттың таралуы Генри заңына бағынады. Қазіp абсорбциялық құбылыстар өнеркәсiпте кеңiнен қолданылуда. Мысалы, өнеркасiптегi тұз қышқылын өндiру толығымен хлорлы сутек газын судың абсорбциялау құбылысына негiзделген. Нақ осы құбылысқа, яғни газдардың абсорбциясына сүйенiп газдарды зиянды қоспадан тазартады, газ қоспасын бөледi.
Хемосорбция дегенiмiз сiңетiн және сiңiретiн заттар арасындағы әрекеттесу терең жүру нәтижесiнде жаңа химиялық зат пайда болатын процесс. Бұған мысал ретiнде натронды iзбестiң көміртек (IV) оксидi мен күкірт (IV) оксидiн өзiне сiңiрiп, карбонат пен сульфат тұздарын түзетiнiн келтiруге болады. Хемосорбцияны физикалық сорбция мен абсорбциядан осы құбылыстар кезiнде бөлiнетiн жылу шамасын өлшеп, ажыратуға болады.
Адсорбция құбылысы. Термодинамиканың екiншi заңына сәйкес бос энергия қоры бар системалар сияқты заттардың жанасу шегiнде де бос энергия қоры болғандықтан, ол өздiгiнен осы энергияны азайтуға ұмтылады. Бұл адсорбция және басқа да физикалық құбылыстардың жүруiне тiкелей не жанама ықпал етедi екен. Адсорбция дегенiмiз eкi фазаның жанасу шегiндегi заттар концентрациясының өздiгiнен өзгеруi немесе әдетте бiреуi қатты зат болып келетiн eкi фазаның жанасу шегiндегi беткi қабатта бiр фаза концентрациясының жоғарылауы. Қалыптасқан терминологияға сәйкес бетiне басқа зат жинақталатынды - адсорбент, жинақталушыны – адсорбтив немесе адсорбат дейдi.
Адсорбция құбылысын түсіндіруге арналған бірнеше теория бар. Олардың бірі – физикалық теория. Бұл теорияға орай, адсорбция күш табиғаты молекулааралық күштердің пайда болуына сәйкес келеді. Ал енді химиялық теорияға жүгінсек, адсорбция жүретін беттегі орналасқан молекулаларда болатын қанықпаған, яғни бос валенттілік есебінен химиялық күш туындайды және ол күш салдарынан байланыс құралып, адсобция жүреді.
1 – т а б л и ц а
| Газ | С м3/ мкг | Т қайнау Қ | Т криз К | Газ | С м3/ мкг | Т қайнау Қ | Т криз К |
| COCI2 O2 NH3 H2S HCI N2O | CO2 CO O2 N2 H2 |
ФИЗИКАЛЫҚ АДСОРБЦИЯ
Физикалық адсорбция теориясының бiрнеше түрлерi белгiлi. Олардың арасында 1915 жылы Ленгмюр ұсынған мономолекулалық адсорбция теориясы едәуiр назар аударарлықтай. Бұл теорияны тұжырымдарда, оның авторы бiрнеше қағидаларға сүйендi:
1.Адсорбция валенттi күштер не артылып қалған (қосымша) химиялық валенттiлiк күштерi арқылы жүзеге асады.
2.Адсорбция берiлген адсорбент бетiнiң (бәрiнде бiрдей жүре бермей, тек ондағы активтi орталықтарда ғaнa жүредi. Осы активтi орталықтардың әcepi онда пайда болатын қанықпаған күш өpiciнің күштi болусалдарынан және соның нәтижесiнде осы орталықтарда газ молекулалары ұсталынып тұрады. әрине, мұндағы адсорбент атомы не молекуласы аз қаныққан сайын, активтi орталықтардың активтiлiгi артық болады.
3. Адсорбциялық күштердiң әсер етушi радиусы кiшi және осының салдарынан әрбiр активтi орталық адсорбтив молекуласының бiреуiн ғана адсорбциялайды, сөйтiп адсорбент бетiнде адсорбтив молекуласының бiр молекулалық (мономолекулалық) қабаты пайда болады.
4. Адсорбент бетiне адсорбцияланған газ молекулалары онда берiк ұсталмайды: олар ылғи тоқтаусыз газды орта мен солшеңберде алмасуда боладыжәне бұлқұбылыс динамикалық адсорбция тепе-теңдiгi орнағанша жүредi. Осы құбылыстар кезiндегi әрбiр молекулаөзi адсорбцияланған бетте, дәлiрек айтқанда активтi орталықта аса ұзақ уақыт ұсталып тұра бермейдi, энергияның басқа молекулаларға ауысуына орай, әуелгi молекулалар жаңадан келгендерге орнын бередi.
ХИМИЯЛЫҚ АДСОРБЦИЯ
Химиялық адсорбцияны немесе хемасорбцияны физикалық адсорбциямен салыстырғанда олхимиялық күш арқылы не соның көмегімен жүзеге асады. Адсорбцияның бұл түpi басқалардан мынадай өзгешелiктерiмен оқшауланады: физикалық (адсорбция қайтымды құбылыс, ал хемосорбция қайтымсыз және физикалық адсорбция жылуы небәрi 8,4-33,5 кДж/моль шамасында болса, ал химиялық адсорбция жылуы бірнеше жүздеген кДж/мольге тең. Температура жоғарылаған сайын физикалық адсорбция төмендесе, химиялық адсорбция жоғарылайды. Химиялық адсорбция жүру үшін, оған біршама көбірек активтендіру энергиясы (40-120 кДж/моль) қажет.
Химиялық адсобция қамтамасыз болғандықтан, бұл процестегі десорбция адсорбцияланған молекуланы жай ғана жұлып алумен аяқталмайды, адсорбцияланған беттегі химиялық құбылыстың ыдырауы бітеді. Химиялық адсорбцияға бірден-бір мысал ретінде активті көмірдің оттекті адсорбциялауын алуға болады. Хемосорбция процесін схемалық түрде, мына келесідей етіп көрсетуге болады.
 О О О О
О О О О
| | | | | | | |
С С С С С С С С
 |  |  |  |  |  |  |  |  |







 С С С С С С
С С С С С С
С С С С С С С С
 |  |  |  |  |  |  |  |  |  |  |
Егер оттекпен адсорбцияланған активтелген көмiрдi ауасыз ортада қыздырса, одан таза көмір (көміртек) белiнбестен, көміртек (IV) оксидi бөлiнедi.
Адсорбция құбылысына қазiргi теория мен қолданылмалық тарапынан қарасақ, онда физикалық әpi химиялық күштердiң болатыны аңғарылады, яғни адсорбция физикалық-химиялық құбылыс екен. Оны совет ғалымдары Н. А. Шилов, М. М. Думанский мұқият зерттей келiп, адсорбент пен адсорбцияланушы заттар арасындағы әрекеттесулерде физикалық және химиялық құбылыстардың өзiндiк орны болатынын дәлелдедi. Бұл, әcipece, газдар адсорбцияланған кезде айқын көрiнедi. Мұндағы зерттеулерге зер салса, әуелi газдар таза адсорбент бетiмен жанасқанда химиялық адсорбция жүредi екен, өйткенi осы тұста химиялық күш әсер етедi, ал сонан cоң адсорбция құбылысы онан әpi жалғасса және осы кезде қысымды арттырса, онда физикалық адсорбция жүреді.
| <== previous lecture | | | next lecture ==> |
| Натрий додецилсульфаты БАЗ анионы катион | | | АДСОРБЦИЯ ТVРЛЕРI |