
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Химические свойства d-элементов
Обучающие задачи и упражнения
Упражнение 1.Определите степень окисления комплексообразователя в комплексном соединении [Cо(NH3)5Br]SO4
Решение:Внешняя сфера SO4 2-, имеет заряд -2, значит внутренняя сфера [Cо(NH3)5Br] имеет заряд +2. [Cо(NH3)5Br]2+
Поскольку заряд внутренней сферы определяется как алгебраическая сумма заряда комплексообразователя и лигандов, можно определить степень окисления комплексообразователя, т.е. кобальта. Зная, что заряд NH3 равен 0, а для Br-1, степень окисления Со будет равна +3.
Ответ: +3
Упражнение 2. Определите заряд комплексного иона и тип гибридизации атомных орбиталей комплексообразователя в данном соединении: [Cu+2(H2O)4]x
Решение:Заряд лиганда Н2О равен 0, тогда заряд комплексного иона равен 2+ [Cu+2(H2O)4]2+
Координационное число равно 4, что определяет гибридизацию атомных орбиталей по типу sp3 .
Ответ:2+, sp3 - гибридизация.
Упражнение 3. Запишите константу нестойкости для следующего соединения: Na2[Zn(OH)4]
Решение:В водном растворе соединение полностью диссоциирует на внешнюю и внутреннюю сферу:Na2[Zn(OH)4] ® 2Na+ + [Zn(OH)4]2-
Данный процесс называется первичной диссоциацией. Внутренняя среда диссоциирует слабо, этот процесс является обратимыми и он характеризуется константой равновесия, называемой константой нестойкости
[Zn(OH)4]2- « Zn+2 + 4OH-
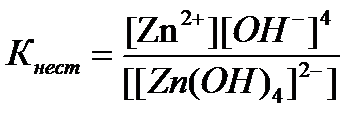
[Zn+2]× [OH-]4
К нест. = ¾¾¾¾¾¾¾
[[Zn(OH)4]2-]
Упражнение 4. Существует два изомера состава CrCl2(NO2)(NH3)4. Один из них дает осадок с раствором нитрата серебра, другой не образует осадка. Чем можно объяснить это различие в поведении двух изомеров?
Ответ:
1. [Cr(NH3)4 Cl2]NO2 + AgNO3 ¾® [Cr(NH3)Cl(NO2)]NO3 + AgNO2 осадка нет
2. [Cr(NH3)Cl(NO2)]Cl + AgNO3 ¾¾¾® [Cr(NH3)Cl(NO2)]NO3 + AgCl¯
выпадает осадок, т.к. в комплексном соединении хлорид-ион находится во внешней сфере.
Упражнение 5. Британский антилюизит (БАЛ) используется как антидот при отравлении солями ртути. Запишите уравнение взаимодействия солей ртути с БАЛ в качестве лечебного средства.
Ответ
Упражнение 6. Сколько изомеров существует у иона [Co(H2N-CH2-CH2-NH2)2Cl2]+ ? Ответ обоснуйте и проиллюстрируйте.
Ответ:Существует 2 изомера транс (а)- и цис- изомер (б).
а- транс-изомер б –цис-изомер
Упражнения и задачи для самостоятельной работы
Упражнение 1. Определите степень окисления комплексообразователя, назовите комплексное соединение и выразите константу нестойкости:
K3[Fe(CN)6] [Co(H2O)6]Cl3 K4[Fe(CN)6] KFe[Fe(CN)6]
Упражнение 2. Отразите химизм взаимодействия унитиола (2,3-димеркаптопропансульфоната натрия) с солями Hg+2.
Упражнение 3. Из предложенных ниже молекул и ионов составьте комплексные соединения анионного, катионного и нейтрального типа (Pt+2, NН3, К+, С1-, Сu+2).Назовите их.
Упражнение 4. В аналитической и медицинской практике используется ЭДТА (этилендиаминтетрауксусная кислота) и его соль Na2H2Т (трилон Б) С какими катионами: Со3+ (kн=2,51×10-41), Мg2+ (kн=7,59×10-10), Fe2+ (kн=6,31×10-15), Fe3+ (kн=5,89×10-25) он образует менее прочное комплексное соединение? Расположите комплексы по убыванию их прочности.
Упражнение 5. Укажите, в состав каких ферментов входит кобальт:
1) карбоангидразы; 3) цитохромов
2) витамина В12 4) супероксиддисмутазы;
5) ксантиноксидазы
Задача 1. При отравлениях ляписом (нитрат серебра) желудок промывают 2%-ным раствором хлорида натрия. Рассчитайте массу AgCl, которая получится при взаимодействии 0,1 г нитрата серебра с избытком хлорида натрия.
Ответ: m(AgCl)=0,084г
Задача 2. Сульфат цинка ZnSO4 применяется в виде 0,25% раствора, как глазные капли. Сколько нужно добавить воды к 25г раствора ZnSO4 c массовой долей 2%, чтобы приготовить глазные капли?
Ответ: 175 г воды.
Задача 3. Массовая доля цинка, входящего в состав яда кобры (ценное лекарство!), равно 0,5%. Сколько атомов цинка потребуется кобре для производства 1 капли (30мг) яда?
Ответ: N (Zn)=1,38×1018 атомов
Тестовые вопросы
1. Медь содержащий белок плазмы крови человека называется______.
1) гемоглобин 2) цитохром 3) альбумин 4) церрулоплазмин
2. Какой микроэлемент входит в состав фермента ксантиноксидазы_______.
1) железо 2) серебро 3) кобальт 4) молибден
3. Какой металл входит в состав гемоглобина?
1) медь (II) 2) железо (II) 3) кобальт (III) 4) железо (III)
4. Какое эндемическое заболевание возникает при избытке Мо6+ в воде и почве?
1) кариес 2) подагра 3) эндемический зоб 4) анемия
5. Какой фермент катализирует процесс гидролиза пептидной связи?
1) глутатион 2) ксантиноксидаза 3)карбопепсидаза 4) каталаза
6) Какой фермент участвует в разложении пероксидов (H2O2)?
1) каталаза 2) инсулин 3) гидроксилаза 4) карбоангидраза
7. Какой раствор соли используют при отравлении ионами серебра?
1) NaCl 2) NaSO4 3) CH3COOH 4) KCl
8. Какая болезнь возникает при избыточном поступлении меди в организм?
1) анемия 3) Коновалова-Вильсона
2) медная анемия 4) остеопороз
9. Общее число электронов в ионе Cr 3+ равно:
1) 21 2) 27 3) 24 4) 52
10. Соль образуется при__________.
1) разложении пероксида водорода 3) обугливании сахара в серной кислоте
2) горении железа в хлоре 4) растворении негашеной извести в воде
11. При частичном восстановлении Сr2O3 образуется_________.
1) СrO 2) СrO4 2- 3) СrO2 – 4) Сr2O7 2-
12. Какие из приведенных оснований проявляют амфотерные свойства?
1) Ca(OH)2 2) Zn(OH)2 3) KOH 4) Fe(OH)2 5) NH4OH
13. С кислотами и щелочами взаимодействует оксид?
1) хрома (VI) 2) магния 3) хрома (II) 4) хрома (III)
14. Эквивалент перманганата калия, если ион MnO-4 восстанавливается до Mn+2, равен ____.
1) 1/5 2) 1/2 3) 1/3 4) 1/4
15. Определите значение фактора эквивалентности для КMnO4 в кислой среде.
1) 1/2 2) 1/5 3) 3/4 4) 1,5 моль
16. Как меняется химическая активность d-элементов побочных подгрупп в направлении сверху вниз?
1) возрастает 2) не изменяется 3) уменьшается 4) изменяется дискретно
17. Какой оксид обладает основными свойствами?
1) FeО3 2) CO2 3) P2O5 4) FeO 5) SO3
18. Гидроксид хрома (III) Сг(ОН)3 может проявлять в окислительно- восстановительных реакциях свойства ____________.
1) только окислителя 3) и окислителя, и восстановителя
2) только восстановителя 4) ни окислителя, ни восстановителя
19. Для ослабления процесса гидролиза хлорида железа (III) к раствору добавляют___.
1) HCl 2) Cl2 3) KOH 4) H2O
20. Сильным электролитом является водный раствор_______.
1) оксида углерода (IV) 3) оксида углерода (II)
2) этанола 4) хлорида меди (II)
21. Хлорид меди (II) образуется при действии соляной кислоты на_________.
1) CuO 2) CuBr2 3) Cu 4) CuCO3
22. Одним из продуктов гидролиза нитрата железа (III) по второй ступени является____.
1) Fe(OH)3 2) FeOH(NO3)2 3) FeOH(NO3 4) Fe(OH)2NO3
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства р-элементов и их соединений | | | Адсорбционные процессы |
Дата добавления: 2014-09-10; просмотров: 751; Нарушение авторских прав

Мы поможем в написании ваших работ!