
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Кривые титрования
Кривая комплексонометрического титрования обычно представляют собой зависимость рM = -lg[M] от степени оттитрованности. В качестве примера рассмотрим кривую титрования 1,0×10-3 М Zn2+ 1,0×10-3 М раствором ЭДТА. Титрование проводится в аммиачном буферном растворе, рН которого равен 9,50, а концентрация NH3 – 5×10-2 моль/л. Поскольку C(NH3) значительно больше С(Zn2+), будем считать, [NH3] » С(NH3). Константа образования комплекса ZnY2- равна 3,2×1016, а её десятичный логарифм – 16,50.
Катион цинка образует аммиачные комплексы, содержащие от 1 до 6 молекул лиганда. Общие константы образования этих комплексов: b1 = 1,5×102; b2 = 2,7×104; b3 = 8,5×106; b4 = 1,2×109; b5 = 2,9×109; b5 = 5,6×1012.
 =
=
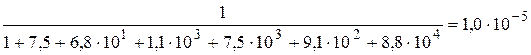
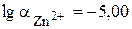
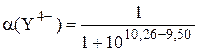 = 1,5×10-1,
= 1,5×10-1, 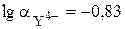 .
.
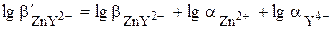 =
= 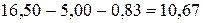
До начала титрования
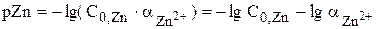
До точки эквивалентности
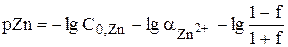
Чтобы получить формулу для расчёта величины pZn в точке эквивалентности, воспользуемся выражением 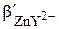 .
.
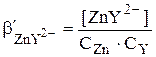
где СZn и CY – общие концентрации, соответственно ионов Zn2+ и ЭДТА, образовавшихся при диссоциации комплекса ZnY2-.
С учётом того, что в точке эквивалентности CZn = CЭДТА
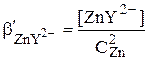
Если принять, что степень диссоциации комплекса ZnY2- пренебрежимо мала, то
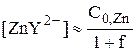
С учётом того, что 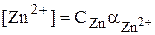 :
:
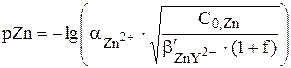 =
=
= 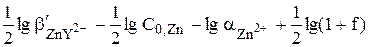
Для того чтобы получить формулу для расчёта pZn после точки эквивалентности, также воспользуемся формулой, описывающей условную константу образования комплекса.
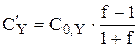
Так как 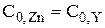 , то
, то
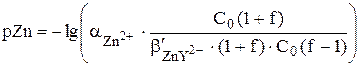 =
=
= 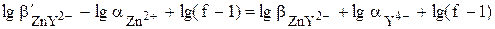
Формулы для расчёта рZn в различных точках кривой титрования и рассчитанные по ним значения рZn приведены в табл. 15.1. Кривая титрования показана на рис. 15.3.
На величину скачка титрования в комплексонометрии влияют (рис. 15.4):
· исходные концентрации титруемого иона и титранта,
· устойчивость комплекса катиона металла с ЭДТА,
· величины 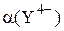 и
и 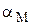 в условиях титрования.
в условиях титрования.
Молярная доля Y4- зависит от рН, а величина 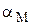 – от концентрации комплексообразующего реагента и устойчивости образующихся комплексов
– от концентрации комплексообразующего реагента и устойчивости образующихся комплексов
Табл. 15.1
Расчёты для построения кривой титрования 1,0×10-3 М Zn2+
1,0×10-3 М раствором ЭДТА при рН 9,50 в присутствии 5×10-2 М NH3
| f | Расчётная формула | pZn |
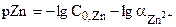
| 8,00 | |
| 0,10 | 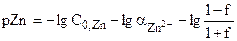
| 8,09 |
| 0,50 | аналогично | 8,48 |
| 0,90 | аналогично | 9,28 |
| 0,99 | аналогично | 10,3 |
| 0,999 | аналогично | 11,3 |
| 1,00 | 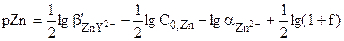
| 12,0 |
| 1,001 | 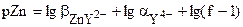
| 12,7 |
| 1,01 | аналогично | 13,7 |
| 1,10 | аналогично | 14,7 |
| 1,50 | аналогично | 15,4 |
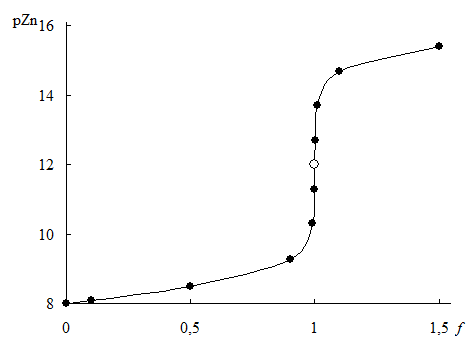
Рис. 15.3. Кривая титрования 1,0×10-3 М Zn2+ 1,0×10-3 М раствором ЭДТА при рН 9,50 в присутствии 5×10-1 М NH3
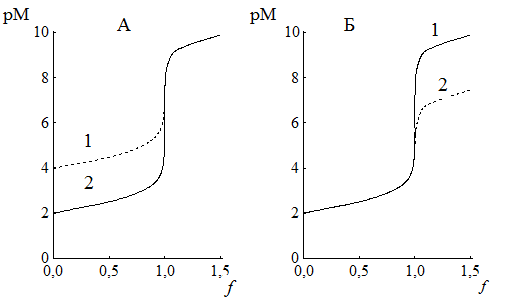
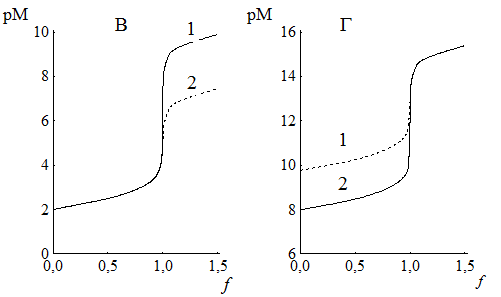
Рис. 15.4. Влияние различных факторов на величину скачка комплексонометрического титрования
А - концентрация титруемого иона (pH 10, Ca2+) - 1) 1,0×10-4 М; 2) 1,0×10-2 М;
Б -устойчивость комплекса (рН 10, 1,0×10-2 М) - 1) Ca2+, 2) Ba2+;
B - pH ( Сa2+, 1,0×10-2 М) - 1) pH 10; 2) pH 7;
Г – концентрация NH3 (рН 9,5, 1,0×10-3 М Zn2+) – 1) [NH3] = 1×10-1 М; 2) [NH3] = 5×10-2 М
Изменение исходной концентрации титруемого вещества и концентрации вспомогательного реагента (а также и рН, если происходит образование гидроксокомплексов металла) влияют на ход кривых титрования до точки эквивалентности, в то время как pH и устойчивость комплекса – после точки эквивалентности.
Для каждого металла существует определённое значение рН, ниже которого комплексонометрическое титрование с удовлетворительной погрешностью оказывается невозможным.
При начальной концентрации титруемого катиона 1×10-2 моль/л и допустимой погрешности Ÿ 0,1% минимальная величина условной константы образования комплекса металла с ЭДТА составит
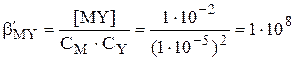
Таким образом, комплексонометрическое титрование 1×10-2 М раствора катиона металла с погрешностью — 0,1% можно провести при таких значениях рН, чтобы величина 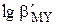 оставалась большей 8. Например, минимальное значение рН для титрования 1×10-2 М Ca2+ составляет ~ 7,5, 1×10-2 М Mg2+ ~ 9,8. Комплексонометрическое определение таких катионов проводят в щелочной среде. Ионы, образующие очень прочные комплексы с ЭДТА, можно титровать с допустимой погрешностью даже в сильнокислой среде. Например, даже при рН 1,0 величина
оставалась большей 8. Например, минимальное значение рН для титрования 1×10-2 М Ca2+ составляет ~ 7,5, 1×10-2 М Mg2+ ~ 9,8. Комплексонометрическое определение таких катионов проводят в щелочной среде. Ионы, образующие очень прочные комплексы с ЭДТА, можно титровать с допустимой погрешностью даже в сильнокислой среде. Например, даже при рН 1,0 величина 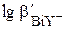 остаётся равной 9,4. Поскольку уже в слабокислой среде ионы типа Bi3+ или Fe3+ образуют гидроксокомплексы и малорастворимые гидроксиды, их комплексонометрическое определение проводится в сильнокислой среде.
остаётся равной 9,4. Поскольку уже в слабокислой среде ионы типа Bi3+ или Fe3+ образуют гидроксокомплексы и малорастворимые гидроксиды, их комплексонометрическое определение проводится в сильнокислой среде.
Ионы типа Zn2+ или Ni2+ определяют в слабощелочной среде. Для поддерживания определённого значения рН используют аммиачный буферный раствор. Роль буферного раствора заключается не только в создании определённого значения рН, но и в предотвращении выпадения осадков гидроксидов металлов. Концентрация NH3 в буферном растворе должна быть такой, чтобы не происходило образование осадка гидроксида металла, но при этом устойчивость комплекса металла с ЭДТА оставалась бы приемлемой для проведения титрования. Например, в присутствии 1,0 М NH3 при рН 10,0 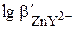 = 3,30. Комплексонометрическое определение Zn2+ с удовлетворительной погрешностью оказывается невозможным.
= 3,30. Комплексонометрическое определение Zn2+ с удовлетворительной погрешностью оказывается невозможным.
| <== предыдущая страница | | | следующая страница ==> |
| Комплексонометрическое титрование | | | Способы обнаружения конечной точки титрования. Металлоиндикаторы |
Дата добавления: 2014-10-10; просмотров: 860; Нарушение авторских прав

Мы поможем в написании ваших работ!