
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Способы обеспечения клеток энергией
Основные понятия.Величины, характеризующие состояние термодинамической системы (давление р, удельный и молярный объем Vуд, Vмол, абсолютная температура Т) называются термодинамическими параметрами.
Совокупность всех значений термодинамических параметров, необходимых для описания системы, называется термодинамическим состоянием.
Физическая характеристика системы, изменение которой при переходе системы из одного состояния в другое определяется значениями параметров начального и конечного состояний и не зависит от перехода, называется функцией состояния (термодинамическим потенциалом).
Функциями состояния являются:
· внутренняя энергия;
· энтальпия;
· энтропия;
· свободная энергия;
· химический и электрохимический потенциалы.
Количество какой-либо величины, переносимое в единицу времени через некоторую поверхность, называется потокомэтой величины.
Явление, при котором один процесс энергетически обеспечивает протекание второго процесса, называется сопряжением.
Процесс, который является источником энергии, называется сопрягающим. Процесс, на который тратиться энергия называется сопряженным.
Первый и второй законы термодинамики.Согласно первому закону термодинамики, который звучит следующим образом: теплота сообщенная системе, расходуется на приращение внутренней энергии системы и совершение системой работы над внешними силами, различные виды энергии могут переходить друг в друга, но при этих превращениях Ī энергия не исчезает и не появляется из ничего. Это означает, что для замкнутой системы
∆U = ∆Q –W, где ∆U – изменение внутренней энергии системы; ∆Q - тепло, поглощенное системой; W – работа, совершаемая системой. [Внутренняя энергия отличается от теплоты и работы тем, что она всегда меняется одинаково при переходе из одного состояния в другое независимо от пути перехода!].
Изменение тепловой энергии ∆Q изолированной системы пропорционально абсолютной температуре T, то есть ∆Q = T ∙ ∆S, где ∆S - коэффициент пропорциональности, который называется изменением энтропии.
Второй закон термодинамики существует в двух формулировках. Первая формулировка (формулировка Клаузиуса ) звучит следующим образом: невозможен самопроизвольный переход тепла от тел с более низкой температурой к телам с более высокой температурой. Вторая формулировка ( формулировка Томсона ) говорит о том, что невозможно создание вечного двигателя ĪĪ рода, то есть такого циклического процесса, в результате которого всё поглощенное системой тепло расходовалось бы на совершение работы. Согласно второму закону термодинамики, энтропия изолированной системы в необратимом процессе возрастает, а в обратимом процессе остается неизменной. Энтропия – это функция состояния системы, дифференциал которой в бесконечно малом обратимом процессе равен отношению бесконечно малому количеству тепла, сообщенного системе, к абсолютной температуре последней (ΔS=ΔQ:T ). Единица измерения энтропии - Дж/К. Энтропия есть мера неупорядоченности системы: если энтропия растет, то это означает, что система стремится перейти в состояние с большей термодинамической вероятностью, то есть в состояние менее упорядоченное. Из второго закона термодинамики следует вывод: при постоянной температуре тепловую энергию невозможно превратить в механическую работу. Так как тепловая энергия обусловлена хаотическим движением частиц, то сумма векторов скорости этих частиц в любом направлении равна нулю. В механическую же работу можно превратить только ту энергию, которая представляет собой однонаправленное движение тел (кинетическую энергию летящего тела, энергию движущихся ионов или электронов в электрическом поле).
Вывод по двум законам:
Первый закон устанавливает количественное соотношение между теплотой, работой и изменением внутренней энергией, но не определяет направление термодинамического процесса. Он выполняется всегда и для любых систем. Основное соотношение термодинамики: TΔS ≥ ΔU+W.
Второй закон является статистическим и справедлив для систем с большим, конечным числом частиц. Он указывает наиболее вероятное направление процесса. Если утверждается, что данный процесс невозможен, то следует понимать, что вероятность его совершения существует, но ничтожно мала.
Таблица 1. Термодинамические потенциалы
| Постоянные параметры | Название потенциала | Вид функции | Условия равновесия |
| V, S | Внутренняя энергия – изохорно-изоэнтропийный | ΔU | U=Umin |
| P, S | Энтальпия – изобарно-изоэнтропийный | ΔH=ΔU+pΔV | H=Hmin |
| T, V | Свободная энергия Гельмгольца – изохорно-изотермический | ΔF=ΔU-TΔS | F=Fmin |
| T, P | Термодинамический потенциал Гиббса – изобарно-изотермический | ΔG=ΔU+pΔV-TΔS | ΔG=Gmin |
Превращение энергии в живой клетке.В живой клетке химическая энергия, которая запасается в органических соединениях, превращается в осмотическую, электрическую и механическую энергии. Так, например, химическая энергия глюкозы превращается в ходе клеточного окисления частично в тепло, частично – в энергию макроэргических связей АТФ. За счет гидролиза АТФ может происходить перенос веществ из области меньшей в область большей концентрации (осмотическая работа), перенос ионов в область более высокого электрического потенциала (электрическая работа), в организме животного – сокращение мышц (механическая работа). При этом происходит перевод части химической энергии АТФ в осмотическую, электрическую и механическую энергию.
Свободная энергия и электрохимический потенциал.Электрическая, осмотическая и химическая энергия клетки используется для совершения работы, то есть для направленного перемещения частиц против действующих на них сил. Количественной мерой превращения этих видов энергии служит изменение свободной энергии (∆F). ΔF – это свободная энергия Гельмгольца (ΔF =ΔU – TΔS). Так как она зависит от условий протекания процесса, в частности от концентрации реагирующих веществ, то стали использовать так называемый термодинамический потенциал Гиббса 1 моля вещества ΔG. В химии для незаряженных частиц он называется химическим потенциалом – μ, дл заряженных частиц –электрохимическим потенциалом - μ.
Протекание химических реакций в жидкой фазе не изменяет давления, но может изменить объём. Поэтому для таких систем вместо изменения внутренней энергии используют изменение энтальпии (∆H), которое равно ∆U+p∆V, где p – давление, ∆V – изменение объёма. [Примечание: энтальпия – функция состояния термодинамической системы при независимых параметрах энтропии и давлении]. Согласно законам термодинамики между изменением внутренней энергии и изменением энтальпии существует соотношение: ∆G = ∆H -T∆S (при t и p = const), где ΔG - термодинамический потенциал Гиббса, ΔH – внутренняя энергия, T * ΔS – тепловая энергия.
В физико-химических системах изменение свободной энергии обычно описывают через изменение электрохимического потенциала (∆μ): ∆G=m∙∆μ, где m – количество вещества (моли) в системе. Изменение электрохимического потенциала при переходе системы из состояния 1 в состояние 2 определяется изменением химической, осмотической и электрической энергий: ∆μ = μ02-μ01 +RT ln (c2/c1) + zF (φ2-φ1). Тогда ∆G = m • μ02-μ01 +RT ln (c2/c1) + zF (φ2-φ1).
Физический смысл электрохимического потенциала заключается в том, что его изменение равно работе, которую необходимо затратить, чтобы:
1. синтезировать 1 моль вещества (состояние 2) из исходных веществ (состояние 1) и поместить его в растворитель (слагаемое μ02-μ01) – химическая работа;
2. сконцентрировать раствор от концентрации с1 до с2 [слагаемое RT ln (c2/c1)] – осмотическая работа;
3. преодолеть силы электрического отталкивания, возникающие при наличии разности потенциалов (φ2-φ1) между растворами [слагаемое zF (φ2-φ1] – электрическая работа.
Необходимо отметить, что слагаемые могут быть как положительными, так и отрицательными.
Второй закон термодинамики и условие равновесия.Второй закон термодинамики гласит, что в изолированной системе не может увеличиваться свободная энергия. Иначе говоря, в системе, где ∆H = 0, ∆G = -T∆S ≤0. Пока энергетические превращения в данной системе сопровождаются переходами разных видов энергии друг в друга без их перехода в тепло, то есть ∆G=0, все эти процессы обратимы. Но, как только часть энергии превратится в тепловую, процесс становится необратимым. Понятие обратимости процесса связано с понятием динамического равновесия. Равновесие – это такое состояние системы, при котором каждая частица может переходить из некоторого состояния 1 в некоторое состояние 2 и обратно, но в целом доля состояний 1 и состояний 2 в системе не изменяется. В физико-химических системах равновесны процессы, при которых ∆μ = ∆G/m = 0, то есть μ02-μ01 +RT ln (c2/c1) + zF (φ2-φ1)= 0.
В равновесии могут находиться субстраты и продукты биохимической реакции или ионы по обе стороны мембраны. Поэтому существуют приложения к уравнению, описывающего равновесное состояние системы:
1. уравнение константы химического равновесия: ∆μ0 = -RT lnK, где К – константа равновесия;
2. уравнение равновесного мембранного потенциала (уравнение Нернста): если клеточная мембрана проницаема для какого-то одного иона, то на мембране устанавливается равновесный мембранный потенциал: φΜ = φ1 –φ2 = RT/zF • lnc1/c2, при температуре 37С0 φΜ = 60· ln(с1/с2) мВ. Для более краткого написания ввели понятие безразмерного потенциала ψΜ, который равен ln(с1/с2), тогда уравнение Нернста будет выглядеть так ψΜ = ψ1 – ψ2 = ln(с1/с2).
3. распределение Больцмана: если в молекуле существуют два энергетических электронных уровня с энергиями Е1 и Е2, то можно найти заселенность этих уровней электронами в состоянии равновесия: ∆E = E2 – E1.
Экспериментальное определение термодинамических параметров биологических систем.Для определения термодинамических параметров биологических систем используются два метода: определение теплопродукции (калориметрия) и измерение констант равновесия. Так как объект, находящийся в калориметре, не производит работы, изменение энергии (энтальпии) можно считать равным количеству выделившегося тепла ∆Q. Так находят изменение энтальпии ∆H в ходе изучаемого биофизического процесса или биохимической реакции. Другой метод изучения термодинамических параметров основан на измерении констант равновесия при разных температурах. Но этот метод пригоден только тогда, когда изменение энтальпии и изменение энтропии не зависят от температуры. В этом случае пользуются уравнением Вант-Гоффа: lnK = -∆H/RT + ∆S/R (для одного моля вещества).
Организмы как термодинамические системы.При применении термодинамики к биологическим системам необходимо учитывать особенности организации живых систем:
1) биологические системы открыты для потоков вещества и энергии;
2) процессы в живых системах имеют необратимый характер;
3) живые системы далеки от равновесия;
4) биологические системы гетерофазны, структурированы и отдельные фазы могут иметь небольшое число молекул.
Всё это отличает биологические системы от изолированных и близких к состоянию равновесия систем. Поэтому для более адекватного описания свойств живых систем необходимо применять термодинамику необратимых процессов. В отличие от классической термодинамики, в термодинамике необратимых процессов рассматривается ход процессов во времени. Фундаментальным понятием в классической термодинамике является понятие равновесного состояния. В термодинамике необратимых процессов важным понятием является понятие стационарного состояния системы.
Примечание: Необходимо учитывать, что живой организм постоянно развивается и изменяется и поэтому в целом не является стационарной системой. При этом существует допуск: в течение небольшого интервала времени состояние некоторых его участков принимается за стационарное.
В отличие от термодинамического равновесия стационарное состояние характеризуется
· постоянным притоком веществ в систему и удалением продуктов обмена;
· постоянной затратой свободной энергии, которая поддерживает постоянство концентраций веществ в системе;
· постоянством термодинамических параметров (включая внутреннюю энергию и энтропию).
Система в стационарном состоянии может быть как закрытой так и открытой. Открытая система может существовать лишь за счет притока энергии извне и оттока энергии в окружающую среду. В биологических системах наиболее важными потоками являются потоки веществ и электрических зарядов.
Потоки веществ в результате диффузии и электродиффузии. 1. Главной движущей силой при переносе частиц с помощью простой диффузии является градиент концентрации. Поток вещества в результате диффузии через мембрану клетки рассчитывается позакону Фика для пассивного переноса веществ через мембрану: Φ = –DK/l •(cвн-cвв) = –P(cвн-cвв), где Φ – поток; D – коэффициент диффузии; К – коэффициент распределения вещества между мембраной и окружающей водной фазой; l – толщина мембраны; cвв – концентрация частиц внутри клетки; свн – концентрация частиц снаружи клетки; P – коэффициент проницаемости. Если рассматривать диффузию с позиций превращения энергии, то расчет необходимо вести по следующему уравнению: Φ = – uc (dG/dx), где u = D/RT - коэффициент пропорциональности, который зависит от скорости диффузии молекул и называется подвижностью. Таким образом, поток пропорционален концентрации вещества и градиенту термодинамического потенциала в направлении тока.
2. Главной движущей силой при переносе заряженных частиц в отсутствии градиента концентрации является электрическое поле. В этом случае пользуются уравнением Теорелла: Φ = – cu • (dμ/dx), где μ – электрохимический потенциал. Итак, поток равен произведению концентрации носителя на его подвижность и на градиент его электрохимического потенциала. Знак «–« указывает на то, что поток направлен в сторону убывания μ. Кроме того, пользуются электродиффузионным уравнением Нернста – Планка: Φ = –uRT (dc/dx) –cuz• Fdφ/dx.
Потоки и термодинамические силы, обуславливающие протекание жизненно важных процессов, приведены в таблице 3.
Таблица 3. Сопряженные потоки и силы в неравновесной термодинамике
| Название процесса | Название потока | Обобщенная сила |
| Диффузия | Поток незаряженных частиц | Градиент концентрации (dc/dx) |
| Электродиффузия | Поток ионов | Градиент электрохимического потенциала (dμ/dx) |
| Электрический ток | Поток электронов | Градиент электрического потенциала (dφ/dx) |
| Течение жидкости | Объемный поток | Градиент гидростатического давления (dP/dx) |
Термодинамика стационарного состояния.Открытые системы обладают специфическими особенностями: сопряжением потоков и возникновением стационарных состояний. Эти особенности открытых систем объясняет термодинамика линейных необратимых процессов. Она описывает одновременное протекание различных взаимосвязанных стационарных процессов. Теорию термодинамики линейных необратимых процессов сформулировал Онзагер. Экспериментальной основой этой теории являются феноменологические законы, которые устанавливают линейную зависимость между потоками и силами их вызывающими (см.табл.2). Допустим, что в системе имеются два потока – поток тепла (Φ1) и диффузионный поток массы (Φ2) и две обобщающие силы – разность температур X1 и разность концентраций X2. Согласно Онзагеру, в открытой системе каждый поток зависит от всех присутствующих сил, и наоборот, то есть
Φ1 = L11X1 + L12X2
Φ2 = L21X1 + L22 X2,
где L12 и др.- коэффициенты пропорциональности между потоком 1 и силой 2 и т.д.
Эти уравнения называются феноменологическими уравнениями Онзагера. Они указывают на зависимость входных и выходных потоков, как от сопряженных, так и от несопряженных им сил. Как показал Онзагер, вблизи равновесия коэффициенты пропорциональности между потоками равны друг другу ( L12 = L21). Иначе говоря, равное действие вызывает равную ответную реакцию. Например, тормозящее действие, которое оказывает движущийся растворитель на растворенное вещество, равно сопротивлению, которое растворенное вещество оказывает на растворитель.
В природе существует ситуация, когда потоки, идущие с повышением энергии, самостоятельно идти не могут, но могут протекать при действии каких-либо сил. Это явление называетсясопряжением потоков. Критерием возможности сопряжения потоков в системе является положительное значение диссипативной функции ψ = Τ/V•dS/dt ≥ 0, где Τ – абсолютная температура; dS/dt – скорость продукции энтропии; V – объем системы.
Диссипативная функция является мерой рассеяния энергии системы в тепло. Она определяет скорость возрастания энтропии в системе, в которой протекают необратимые процессы. Чем выше величина диссипативной функции, тем быстрее энергия всех видов превращается в тепловую. Кроме этого диссипативная функция определяет возможность самопроизвольного протекания процесса: при ψ>0 процесс возможен, при ψ<0 – нет.
Термодинамика показывает, что если система неравновесна, но близка к равновесию, то ψ может быть представлена суммой произведений обобщенных сил - Xi и обобщенных потоков - Φi, то есть суммой мощностей процессов ψ = ∑ΦiXi ≥0. Положительное значение диссипативной функции ψ означает, что в любом преобразователе энергии входная мощность должна превышать выходную. В большинстве биологических процессов происходит преобразование химической энергии в осмотическую, электрическую и механическую. Во всех этих процессах происходит диссипация части химической энергии в тепло. Для биологических процессов эффективность сопряжения составляет 80-90%, то есть всего 10-20% энергии переходит в тепло.
Стационарное состояние открытой системы характеризуется теоремой Пригожина: в стационарном состоянии при фиксированных внешних параметрах скорость продукции энтропии в системе постоянна по времени и минимальна по величине.
Если критерием эволюции системы в классической термодинамике является то, что энтропия для необратимых процессов в изолированной системе стремится к максимальной величине(критерий Клаузиуса), то в открытой системе производство энтропии стремится к минимуму(критерий Пригожина). Критерий Пригожина (Δψ>0) - критерий устойчивости – при отклонении от устойчивого состояния Δψ<0. Это является доказательством того, что второй закон термодинамики выполняется в живой природе.
Из теоремы Пригожина следует, что, если система выведена из стационарного состояния, то она будет изменяться до тех пор, пока удельная скорость продукции энтропии не примет наименьшего значения. То есть пока диссипативная функция не достигнет минимума.
Пути преобразования энергии в живой клетке.Молекулярный механизм сопряжения реакций окисления и фосфорилирования был расшифрован Митчеллом в 1976 году. Автор разработал хемиосмотическую теорию окислительного фосфорилирования. Вторая часть теории Митчелла заключается в том, что в мембране существует асимметричная АТФ-аза, которая работает обратимо, то есть может быть и АТФ-синтетазой:
АТФ + НОН (атф-аза) АДФ + Ф + 2Н+
Асимметричность в действии АТФ-азы заключается в том, что
а) при гидролизе АТФ протон Н+ и гидроксил ОН- захватываются по разные стороны от мембраны;
б) при синтезе АТФ вода диссоциирует на ОН-, который поступает в более закисленную от мембраны сторону, и Н+, который диффундирует в противоположную сторону.
В целом процесс фосфорилирования АДФ осуществляется за счет изменения свободной энергии при нейтрализации иона ОН- в кислой среде, и иона Н+ в щелочной среде.
С точки зрения преобразования энергии процесс окислительного фосфорилирования состоит из двух стадий:
1. Превращение химической энергии переноса электронов в энергию, связанную с разностью электрохимических потенциалов протонов в результате сопряжения переноса электрона по дыхательной цепи и переноса протона через мембрану. При этом: ΔμH+ = FΔφM + RT ln ([H+]1/[H+]2), где ΔμH+ - разность электрохимических потенциалов; ΔφM – разность электрических потенциалов между внешней и внутренней сторонами мембраны митохондрий; ([H+]1 и [H+]2 – концентрации протонов в окружающей среде и внутри митохондрий.
2. Превращение энергии, определяемой разностью электрических потенциалов, в химическую энергию макроэргической связи АТФ (сопряжение переноса 2Н+ и синтеза одной молекулы АТФ из АДФ и фосфата). Это условно можно изобразить в виде ΔμH+ → QUOTE ~ ~.
В настоящее время показано, что при наличии разности электрохимических потенциалов Н+ на сопрягающей мембране может совершаться не только химическая работа (синтез АТФ), но и осмотическая работа (при транспорте различных соединений через мембраны), механическая работа (движение жгутиков у бактерий), а также выделяться тепло (теплорегуляторное разобщение окислительного фосфолирилирования).
Символически хемиосмотическая теория сопряжения процессов окисления (т.е. переноса электронов – e) и фосфорилирования (синтез макроэргов - QUOTE ~ ~) может быть представлена в виде схемы e QUOTE 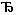
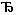 ΔμH+ QUOTE
ΔμH+ QUOTE 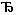
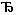 QUOTE ~ ~. Из этой схемы вытекают следующие основные следствия хемиосмотической теории:
QUOTE ~ ~. Из этой схемы вытекают следующие основные следствия хемиосмотической теории:
1. Если ΔμH+= 0, то при переносе электронов не происходит синтез АТФ.
2. При работе дыхательной цепи происходит генерация мембранного потенциала (е→ΔφM).
3. Создание достаточного по величине электрического потенциала на энергосопрягающей мембране со знаком «+» снаружи приведет к синтезу АТФ из АДФ и ортофосфата (ΔφM → QUOTE ~) ~).
4. За счет мембранного потенциала можно остановить и даже «повернуть вспять» поток электронов в дыхательной цепи ( ΔφM →e).
5. При гидролизе АТФ на сопрягающей мембране происходит генерация мембранного потенциала ( QUOTE ~ ~ → ΔφM).
Итак, основные виды работы в живой клетке – электрическая и осмотическая – выполняются при непосредственном участии биологических мембран. Центральную роль в энергетике клетки играют процессы синтеза и распада АТФ. В клетке АТФ является аккумулятором химической энергии.
Энергия используется для различных химических реакций, протекающих в клетке. Одни организмы используют энергию солнечного света для биохимических процессов — это растения, а другие используют энергию химических связей в веществах, получаемых в процессе питания, — это животные организмы. Вещества из пищи извлекаются с помощью расщепления или биологического окисления в процессе клеточного дыхания.
Клеточное дыхание — это биохимический процесс в клетке, протекающий в присутствии ферментов, в результате которого выделяется вода и углекислый газ, энергия запасается в виде макроэнергетических связей молекул АТФ. Если этот процесс протекает в присутствии кислорода, то он носит название «аэробный». Если же он происходит без кислорода, то он называется «анаэробным.
Биологическое окисление включает три основных стадии:
1. Подготовительную,
2. Бескислородную (гликолиз),
3. Полное расщепление органических веществ (в присутствии кислорода).
Подготовительный этап. Поступившие с пищей вещества расщепляются до мономеров. Этот этап начинается в желудочно-кишечном тракте или в лизосомах клетки. Полисахариды распадаются на моносахариды, белки – на аминокислоты, жиры – на глицерины и жирные кислоты. Выделяющаяся на этой стадии энергия рассеивается в виде тепла. Надо отметить, что для энергетических процессов клетки используют именно углеводы, а лучше — моносахариды. А мозг может использовать для своей работы только моносахарид — глюкозу.
Глюкоза в процессе гликолиза распадается на две трехуглеродные молекулы пировиноградной кислоты. Дальнейшая их судьба зависит от присутствия в клетке кислорода. Если в клетке присутствует кислород, то пировиноградная кислота приходит в митохондрии для полного окисления до углекислого газа и воды (аэробное дыхание). Если кислорода нет, то в животных тканях пировиноградная кислота превращается в молочную кислоту. Эта стадия проходит в цитоплазме клетки. В результате гликолиза образуется всего две молекулы АТФ.
Для полного окисления глюкозы обязательно необходим кислород. На третьем этапе в митохондриях происходит полное окисление пировиноградной кислоты до углекислого газа и воды. В результате образуется еще 36 молекул АТФ.
Всего на трех этапах образуется 38 молекул АТФ из одной молекулы глюкозы, учитывая две АТФ, полученные в процессе гликолиза.
Таким образом, мы рассмотрели энергетические процессы, происходящие в клетках. Охарактеризовали этапы биологического окисления. На этом наш урок окончен, всего вам доброго, до свидания!
Отличие дыхания от горения. Дыхание, происходящее в клетке, нередко сравнивают с процессом горения. Оба процесса происходят в присутствии кислорода, выделении энергии и продуктов окисления. Но, в отличие от горения, дыхание — это упорядоченный процесс биохимических реакций, протекающий в присутствии ферментов. При дыхании углекислый газ возникает как конечный продукт биологического окисления, а в процессе горения образование углекислого газа происходит путем прямого соединения водорода с углеродом. Также во время дыхания образуется определенное количество молекул АТФ. То есть дыхание и горение — это принципиально разные процессы.
Биомедицинское значение.Для медицины важен не только метаболизм глюкозы, но также фруктозы и галактозы. Особенно важна в медицине способность к образованию АТФ в отсутствии кислорода. Это позволяет поддерживать интенсивную работу скелетной мышцы в условиях недостаточной эффективности аэробного окисления. Ткани с повышенной гликолитической активностью способны сохранять активность в периоды кислородного голодания. В сердечной мышце возможности осуществления гликолиза ограничены. Она тяжело переносит нарушение кровоснабжения, что может привести к ишемии. Известно несколько болезней, обусловленных отсутствием ферментов, которые регулируют гликолиз:
- гемолитическая анемия (в быстрорастущих раковых клетках гликолиз идет со скоростью превышающей возможности цикла лимонной кислоты), что способствует повышенному синтезу молочной кислоты в органах и тканях. Повышенное содержание молочной кислоты в организме может быть симптомом рака.
Брожение.Микробы способны получать энергию в процессе брожения. Брожение известно людям с незапамятных времен, например, при изготовлении вина. Еще ранее было известно о молочнокислом брожении. Люди потребляли молочные продукты, не подозревая, что эти процессы связаны с деятельностью микроорганизмов. Это впервые доказал Луи Пастер. Причем разные микроорганизмы выделяют разные продукты брожения. Сейчас мы поговорим о спиртовом и молочнокислом брожении. В результате образуется этиловый спирт, углекислота и выделяется энергия. Пивовары и виноделы использовали некоторые виды дрожжей для стимуляции брожения, в результате которого сахара превращаются в спирт. Брожение производят главным образом дрожжи, а также некоторые бактерии и грибы. В нашей стране традиционно используются дрожжи сахаромицеты. В Америке — бактерии рода псевдомонас. А в Мексике используются бактерии «подвижные палочки». Наши дрожжи, как правило, сбраживают гексозы (шестиуглеродные моносахариды), такие как глюкоза или фруктоза. Процесс образования спирта можно представить следующим образом: из одной молекулы глюкозы образуется две молекулы спирта, две молекулы углекислого газа и две молекулы АТФ. Этот способ менее выгоден, чем аэробные процессы, но позволяет поддерживать жизнь в условиях отсутствия кислорода. А теперь давайте поговорим о кисломолочном брожении. Одна молекула глюкозы образует две молекулы молочной кислоты и при этом выделяется две молекулы АТФ. Молочнокислое брожение широко используется для производства молочных продуктов: сыр, простокваша, йогурты. Также молочная кислота используется при изготовлении безалкогольных напитков.
| <== предыдущая страница | | | следующая страница ==> |
| Жизнь с позиции термодинамики | | | Основные свойства живого вещества |
Дата добавления: 2014-03-11; просмотров: 855; Нарушение авторских прав

Мы поможем в написании ваших работ!