
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
И СГОРАНИЯ
|
Читайте также: |
ПРИБЛИЖЕННЫЕ МЕТОДЫ РАСЧЕТА ТЕПЛОТ ОБРАЗОВАНИЯ
ТЕРМОХИМИЯ. ЗАКОН ГЕССА
Tермохимия - раздел химии, занимающийся изучением теплот химических реакций, фазовых превращений и др. процессов. Эти данные широко используются при расчетах тепловых балансов процессов и для расчета химического равновесия.
Тепловой эффект химической реакции - теплота, сопровождающая реакцию, при условиях одинаковой температуры исходных веществ и продуктов реакции. Различают Qр = DH и Qv = DU
Qp = Qv + DnRT
Реакции с выделением теплоты называют экзотермическими
DН < 0 Qр>0
Реакции с поглощением теплоты называют эндотермическими
DH > 0 Qp<0
При написании термохимических уравнений реакции указывают агрегатное состояние реагентов и тепловой эффект реакции. За стандартное состояние
принимают состояние абсолютно чистого вещества находящегося при 298°С и при давлении 0,1013 МПа (1атм).
Закон Гесса (1836г.) - если из данных исходных веществ можно получить заданные конечные вещества различными путями, то суммарная теплота на одном каком-нибудь пути равна суммарной теплоте процесса на любом другом пути, т. е. тепловой эффект химической реакции зависит только от начального и конечного состояний системы, но не зависит от пути перехода.
Большое практическое значение имеют расчеты тепловых эффектов химических реакций по теплотам образования и сгорания, которые можно найти в справочнике.
Теплота образования вещества - это тепловой эффект образования данного вещества из простых веществ, находящихся в наиболее термодинамически устойчивом состоянии. Обозначается DHf,2980
Ca(т) + С(т) + 3/2 О2 = СаСО3(т) +DН0f.298
Первое следствие из закона Гесса - тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ.
n1A1 + n2A2 = n3A3 + n4A4 + DHx
DHx = n3DHfA3 +n4DHfA4 - n1DHfA1 - n2DHfA2
Теплота сгорания вещества - количество теплоты, которое выделяется при полном сгорании одного моля вещества до высших окислов при данных условиях.
С6Н6 + 15/2O2 = 6CO2 + 3Н2О + DНС
Второе следствие из закона Гесса - тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и теплот сгорания
продуктов реакции
DHx = n1DHcА1 + n2DHcА2 - n3DHcА3 -n4DHcА4
1.По энергии разрыва связей
DHf = S(nieI)исх + nQCвозг - S(nieI)кон
где e - энергия разрыва связей,QCвозг - теплота возгонки углерода
2.Эмпирическая формула расчета теплоты сгорания органического соединения в газообразном состоянии
DHc298 = - ( 204,2 n + 44,4 m + Σx ) кдж/моль,
где n - число атомов кислорода, необходимое для полного сгорания вещества
m - число молей образующейся воды
Σх - поправка (термическая характериcтика), которая находится по справочнику для различных гомологических рядов
3.Метод тепловых поправок
Расчет строится на основе значений DН0f298 для веществ, лежащих в основе соответствующего гомологического ряда. В эти основные величины вводят поправки на увеличение углеродной цепи, замещение простых связей сложными и т.д.
Порядок расчета
1.Выбирают основное вещество, из которого минимальным числом замещений можно получить структурную формулу соединения. Находят DНf 298 основного вещества.
2.Последовательным введением в основное вещество групп –СН3 строят углеродный скелет рассматриваемого соединения, при этом на каждую группу
- СН3 вносят поправки в основную величину DНf 298.
3.После построения углеродного скелета соединения замещают простые связи сложными и вводят соответствующие поправки.
4.Замещают группировки –СН3 другими группами и вводят соответствующие поправки.
1.6 ТЕПЛОЕМКОСТЬ. СВЯЗЬ ТЕПЛОЕМКОСТИ С
ТЕРМОДИНАМИЧЕСКИМИ ФУНКЦИЯМИ
Теплоемкостью называют количество теплоты, необходимое для нагревания единицы массы вещества на 1 К. Различают удельную и молярную теплоемкости. Также различают истинную и среднюю теплоемкости. Средней молярной теплоемкостью называют отношение количества теплоты, подведенного к одному молю вещества, к разности температур (Т2 – Т1).
С = 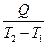
Истинной молярной теплоемкостью называют отношение бесконечно малого количества теплоты, которое нужно подвести к одному молю вещества, к бесконечно малому приращению температуры, которое при этом наблюдается
. C = 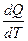
Q = 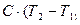 =
= 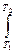 C dT
C dT
С = 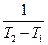
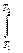 CdT
CdT
CV = 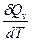 =
= 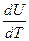
DU = 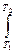 CV dT
CV dT
DU = CV (T2 – T1)
CP= 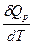 =
= 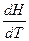
DH = 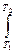 CP dT
CP dT
DH = CP(T2 –T1)
В расчетах Ср определяют по опытным данным для Сv и наоборот. Для этого нужно знать разность теплоемкостей (Cp – Cv).
Cp - Cv = 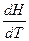 -
- 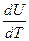 =
= 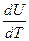 +
+ 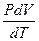 -
- 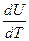 =
= 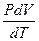 = R
= R
Теплоемкость вещества лишь в сравнительно узком интервале температур можно считать независимой от температуры. Вообще говоря, теплоемкость есть сложная функция от температуры и может быть рассчитана лишь квантовомеханически. Практически зависимость теплоемкости выражается с помощью ряда, коэффициенты которого определяются опытным путем.
Ср = а + вТ + с Т2
СV = а + вТ + с`Т-2
| <== предыдущая страница | | | следующая страница ==> |
| ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ К ПРОЦЕССАМ В ЛЮБЫХ СИСТЕМАХ | | | УРАВНЕНИЯ КИРХГОФФА |
Дата добавления: 2014-03-11; просмотров: 404; Нарушение авторских прав

Мы поможем в написании ваших работ!