
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЭЛЕКТРОХИМИЧЕСКОЕ ПЕРЕНАПРЯЖЕНИЕ
|
Читайте также: |
В 1930г. Эрдей Груз и М. Фольмер вывели уравнение, описывающее зависимость скорости реакции перехода от потенциала. Скорость гетерогенной химической реакции для простоты первого порядка, отнесенная к единице поверхности твердой фазы, описывается известным уравнением химической кинетики:
v = - = kCe- ,
где v -скорость реакции, k - константа скорости реакции, С - концентрация реагирующего вещества на границе раздела фаз, Е - энергия активации процесса. Множитель e-E/RT показывает долю вещества от концентрации С, способную вступить в химическое взаимодействие (долю частиц, энергия которых равна и выше Е). Для электрохимического процесса
Ox + ze = Red
уравнение принимает вид
i+ = k`+[Red] e- ;
i- = -k`-[Ox] e- ,
где i+ и i- - анодный и катодный тoки, k'+_ и k`--константы скоростей катодной и анодной реакций, [Red] и [Ox] -активные концентрации восстановленной и окисленной формы вещества. Знак минус перед правой частью уравнения необходим, чтобы получить отрицательное значение катодного тока.
Характерно, что энергия активации стадии перехода зависит от величины потенциала. Уменьшение потенциала приводит к уменьшению Е- и к увеличению Е+, а увеличение - к увеличению Е-_и к уменьшению E+. С учетом зависимости Е- и Е+ от потенциала уравнение записывается следующим образом:
i+ = k+ [Red] e2,3j/ba;
i- = -k- [Ox] e-2,3j/bk ,
где baи bk - коэффициенты пропорциональности для анодной и катодной реакций.
Из уравнения Фольмера следует, что скорость электродной реакции находится в экспоненциальной зависимости от потенциала. При увеличении потенциала скорость анодной реакции возрастает, а катодной уменьшается.
При значительном смещении потенциала электрода от его равновесного значения ток обратной реакции по сравнению с током прямой реакции становится пренебрежительно малым и внешний ток становится равным прямому току:
ia = k+[Red]e2,3j/ba – k-[Ox]e-2,3j/bk = i+ = k+[Red]e2,3j/ba;
ik = i- = -k-[Ox]e-2,3j/bk .
На рисунке показана зависимость катодного и анодного токов от потенциала
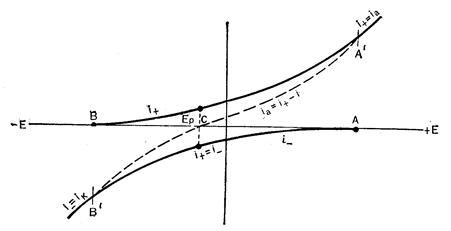
Точка С на оси потенциалов соответствуетравновесному потенциалу, при котором i+ = ½i-½ и внешний ток равен нулю. При потенциале в точке В i+® 0
и ik = i-_, а при потенциале в точке A i- ® 0 и ia = i+. Пунктирная кривая, проходящая через точки В, С, А, является реальной поляризационной кривой, показывающей зависимость внешнего тока от потенциала, который равен алгебраической сумме токов i+. + i- .
Из уравнения Эрдей Груза и Фольмера можно получить зависимость перенапряжения перехода hп от плотности внешнего тока, когда iвн = ia или iвн =ik. Так как согласно уравнению hn=ji-jp ,то из уравнений находят значение ji путем их логарифмирования, а также jр при i+ = ½i-½ = i0 из уравнений. После подстановки значений ji и jр перенапряжение катодной реакции при iвн = i- :
h- = bklgi0 - bk½lgik½.
Перенапряжение анодной реакции
h+ = -balgi0 + balgia.
Если bklgi0 и – balgi0 обозначить через константны ak и aa, то уравнения примут вид
h- = ak - bklg½ik½ ;
h+ = aa + balgia .
Зависимость перенапряжения от плотности тока была установлена опытным путем И. Тафелем и получила название уравнения Тафеля.
| <== предыдущая страница | | | следующая страница ==> |
| КОНЦЕНТРАЦИОННАЯ ПОЛЯРИЗАЦИЯ | | | ПЕРЕНАПРЯЖЕНИЕ ВЫДЕЛЕНИЯ ВОДОРОДА |
Дата добавления: 2014-03-11; просмотров: 460; Нарушение авторских прав

Мы поможем в написании ваших работ!