
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Ионное произведение воды
Процесс электролитической диссоциации воды протекает в две стадии: 1. образование водородных ионов и гидроксид–ионов:
Н2О <=> Н+ + ОН-
2. гидратация водородного иона с образованием гидроксония–иона:
Н+ + Н2О <=> Н3О+.
Первая стадия этого процесса протекает с поглощением тепла, вторая – с выделением его значительного количества. Поэтому практически все ионы водорода гидратированны и диссоциация воды должна изображаться следующим уравнением:
2Н2О <=> Н3О+ + ОН-.
При 22 оС степень электролитической диссоциации воды равна 1,8·10-9, то есть из 555000000 молекул воды диссоциирует одна. Следовательно, вода – очень слабый электролит, и для описания процесса ее диссоциации применим закон действующих масс:
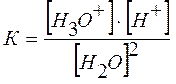 ,
,
где К - константа диссоциации воды.
[Н3О+]·[ОН-] = К·[Н2О]2
Так как [Н2О] = const, то получим:
[Н3О+][ОН-] = Кw.
Постоянная Кw называется ионным произведением воды.
В 1 л воды, массу которой можно принять равной 1000 г, находится 1000 г/18 г = 55,5 моль вещества (ее молярная концентрация).
Следовательно, при 22 °С концентрации ионов гидроксония и гидроксид–ионов равны:
[Н3О+][ОН-] = 55,5·1,8·10-9 = 1,000·10-7 г-ион/л.
Величина Кw возрастает с повышением температуры, так как при этом увеличивается степень электролитической диссоциации: 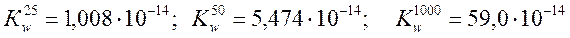 . При комнатной температуре принимают округленное значение ионного произведения воды 10-14.
. При комнатной температуре принимают округленное значение ионного произведения воды 10-14.
| <== предыдущая страница | | | следующая страница ==> |
| Ионообменные реакции | | | Водородный показатель |
Дата добавления: 2014-04-24; просмотров: 345; Нарушение авторских прав

Мы поможем в написании ваших работ!