
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Анионы
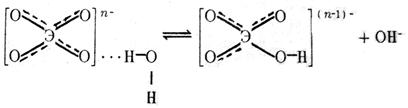 |
Их гидратация осуществляется за счет водородной связи, которая может перейти в ковалентную в результате поляризационного взаимодействия между анионом и молекулами воды:
Чем больше отрицательный заряд и меньше размер аниона, тем он более сильный донор электронных пар и тем легче отрывает протон от молекулы воды. Например, прочность водородной связи возрастает в ряду анионов, образованных p-элементами Ш периода: ClO 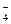 < SO
< SO  < PO
< PO 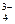 < SiO
< SiO 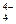 .
.
В зависимости от электродонорной активности анионов возможны два случая:
1) отсутствие заметного разложения молекул воды:
Cl  + HOH D реакция практически не идет;
+ HOH D реакция практически не идет;
NO 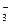 + HOH D реакция практически не идет;
+ HOH D реакция практически не идет;
подобным образом ведут себя слабые доноры электронных пар – однозарядные анионы (Cl ˉ, Brˉ, I ˉ, NO 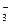 , ClO
, ClO 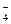 ), анионы SO
), анионы SO  , SiF
, SiF 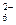 и другие кислотные остатки сильных кислот;
и другие кислотные остатки сильных кислот;
2) обратимое разложение молекул воды:
CO 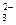 + HOH
+ HOH 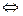 HCO
HCO 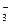
 + OH ˉ.
+ OH ˉ.
Избыток ОН ˉ- ионов обусловливает щелочную реакцию среды. Этот случай характерен для двух- и многозарядных анионов (CO 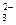 , PO
, PO 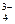 , SO
, SO 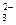 , S
, S 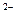 , СN ˉ и т.д.), т.е. кислотных остатков слабых кислот и кислот средней силы. Чем слабее кислота, тем интенсивнее протекает гидролиз.
, СN ˉ и т.д.), т.е. кислотных остатков слабых кислот и кислот средней силы. Чем слабее кислота, тем интенсивнее протекает гидролиз.
Суммарный эффект гидролиза определяется природой находящихся в растворе катионов и анионов.
Различают следующие варианты взаимодействия солей с молекулами воды:
I. Соли сильных оснований и слабых кислот (KCN, CH3COONa, Na2CO3, Na2S, K2S и т.д.).
При диссоциации данных солей в растворе образуется катионы, слабо поляризующие гидратную оболочку, т.е. практически не взаимодействующие с водой, и анионы, поляризующие гидратную оболочку, т.е. обратимо взаимодействующие с водой. В этом случае гидролиз идет по аниону, при этом образуется щелочная среда (рН > 7). Примером служит процесс гидролиза цианида калия КСN - соли, образованной сильным основанием КОН и слабой кислотой НСN:
КCN = K 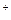 + CN
+ CN  ,
,
К+ + НОН D реакция практически не идет,
СN¯ + НОН D НСN + ОН¯
или в молекулярной форме: КСN + НОН D НСN + КОН.
Второй пример:
Nа2S – соль образована слабой многоосновной кислотой Н2S и сильным основанием NаОН. Так как диссоциация многоосновных кислот протекает ступенчато, то и гидролиз их солей будет также протекать ступенчато.
I ступень:
Na2S = 2Na 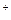 + S
+ S 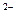 ,
,
Na+ + HOH D реакция практически не идет,
S 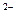 + HOH D НS
+ HOH D НS  + ОН
+ ОН 
или в молекулярной форме
Nа2S + НОН D NаНS + NаОН.
II ступень:
НS– + НОН D Н2S + ОН–
 |
или в молекулярной форме
NаНS + НОН D Н2S + NаОН.
 |
Гидролиз по первой ступени всегда протекает в большей степени, чем по второй. Это обусловлено уменьшением константы диссоциации при переходе от Кд1 к Кд2 (для Н2S Кд1>Кд2): поскольку ион НS  диссоциирует слабее, чем Н2S, то он и образуется в первую очередь при гидролизе Nа2S.
диссоциирует слабее, чем Н2S, то он и образуется в первую очередь при гидролизе Nа2S.
Кроме того, ионы ОН–, образующиеся при гидролизе по первой ступени, способствуют смещению равновесия второй ступени влево, т.е. также подавляют гидролиз по второй ступени.
Вывод: если соль образована сильным основанием и слабой кислотой, то происходит обратимый гидролиз по аниону. Растворы таких солей имеют щелочную среду. В обычных условиях гидролиз по многозарядному аниону протекает по первой ступени с образованием кислых солей, т.к. последующие ступени подавлены из-за накопления в растворе ионов ОН–.
II. Соли слабых оснований и сильных кислот (NH4Cl, CuCl2, CuSO4, ZnCl2, AgNO3 и т.д.).
При диссоциации данных солей образуются катионы, поляризующие гидратную оболочку, т.е. обратимо взаимодействующие с водой, и анионы, слабополяризующие гидратную оболочку, т.е. практически не взаимодействующие с водой. В этом случае гидролиз протекает по катиону, при этом образуется кислая среда (рН<7). Примером служит процесс гидролиза СuСl2, соли, образованной слабым двукислотным основанием Сu(ОН)2 и сильной кислотой НСl:
СuСl2 = Сu2+ + Сl  ,
,
Сu2+ + НОН D СuОН+ + Н+,
Сl– + НОН D реакция практически не идет
или в молекулярной форме
СuСl2 + НОН D СuОНСl + НСl.
Так как диссоциация многокислотных оснований протекает ступенчато, то и гидролиз их солей будет протекать также ступенчато, но константа диссоциации Сu(ОН)2 по первой ступени Кд1 больше константы диссоциации по второй ступени Кд2 (Кд1 > Кд2). Т.е. ион СuОН+ диссоциирует слабее, чем Сu(ОН)2, то он и образуется в первую очередь при гидролизе. Кроме того, ионы Н+, образующиеся при гидролизе по первой ступени, способствуют смещению равновесия второй ступени влево, т.е. подавляют гидролиз по второй ступени, он происходит в ничтожно малой степени и его не учитывают.
Вывод: если соль образована слабым основанием и сильной кислотой, то происходит обратимый гидролиз по катиону. Растворы таких солей имеют кислую среду. В обычных условиях гидролиз по многозарядному катиону протекает по первой ступени с образованием основных солей, т.к. последующие ступени подавлены из-за накопления в растворе ионов Н+.
III. Соли слабых оснований и слабых кислот (Fe2(CO3)3, Al2S3, (NH4)3PO4 и т.д.).
При диссоциации данных солей в растворе образуются катионы и анионы, поляризующие гидратную оболочку, т.е. взаимодействующие с водой. В этом случае гидролиз протекает и по катиону, и по аниону. Примером может служить процесс гидролиза СН3СООNН4 - соли, образованной слабой уксусной кислотой СН3СООН и слабым основанием NН4ОН. Запишем ионно-молекулярные уравнения отдельно для процессов гидролиза катиона и аниона, протекающих одновременно:
СН3СООNН4 = СН3СОО– + NН4+,
 СН3СОО– + НОН D СН3СООН + ОН–,
СН3СОО– + НОН D СН3СООН + ОН–,
NН4+ + НОН D NН4ОН + Н+.
 |
Итак, при гидролизе аниона образуются ионы ОН–, а при гидролизе катиона – ионы Н+. Эти ионы не могут в значительных концентрациях сосуществовать; они соединяются, образуя молекулы слабого электролита - воды. Это приводит к смещению обоих равновесий вправо. Иначе говоря, гидролиз катиона и гидролиз аниона в этом случае взаимно усиливают друг друга и в совокупности процесс протекает практически необратимо.
Суммарное ионно-молекулярное уравнение:
СН3СОО– + NН4+ + Н2О = СН3СООН + NН4ОН.
Молекулярное уравнение:
СН3СООNН4 + Н2О = NН4ОН + СН3СООН.
Реакция растворов солей, образованных слабой кислотой и слабым основанием, определяется относительной силой образовавшихся кислоты и основания, зависит от соотношения их констант диссоциации. Если константа диссоциации кислоты больше константы диссоциации основания, то раствор имеет слабокислую реакцию, при обратном соотношении констант диссоциации – слабощелочную, т.е. рН близко к семи (рН ≈ 7).
Второй пример:
Аl2S3 – соль образована слабым основанием Аl(ОН)3 и слабой кислотой Н2S. Ионы, образовавшиеся в растворе при диссоциации данной соли, будут одновременно подвергаться гидролизу. При этом будет происходить взаимное усиление гидролиза каждого из ионов (смещение химического равновесия вправо) из-за связывания ионов Н+ и ОНˉ в молекулы слабого электролита Н2О. Поэтому гидролиз каждого из ионов будет идти по всем ступеням, до конца с образованием Аl(ОН)3 и Н2S:
Аl2S3 = 2Аl3+ + 3 S2–
I ступень:
 Аl3+ + НОН D АlОН2+ + Н+,
Аl3+ + НОН D АlОН2+ + Н+,
S2– + НОН D НS– + ОН ˉ;
 |
II ступень:
АlОН2+ + НОН D Аl(ОН)2+ + Н+,
 |
НS– + НОН DН2S + ОН ˉ;
 |
III ступень:
Аl(ОН)2+ + НОН = Аl(ОН)3 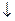 + Н+.
+ Н+.
Суммарное ионно-молекулярное уравнение:
2Аl3+ + 3S2– + 6Н2О = 2Аl(ОН)3 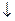 + 3Н2S.
+ 3Н2S.
Молекулярное уравнение:
Аl2S3 + 6Н2О = 2Аl(ОН)3 + 3Н2S.
Вывод: если соль образована слабым основанием и слабой кислотой, то происходит гидролиз и по катиону, и по аниону, взаимно усиливающий друг друга, протекающий практически необратимо с образованием слабого основания и слабой кислоты. Характер среды близок к нейтральному.
IV. Соли сильных оснований и сильных кислот (NаСl, К2SО4, NаNО3 и т.д.).
В этом случае поляризующее влияние катионов и анионов на молекулы воды невелико. Гидролиз практически не происходит,поэтому растворы таких солей практически нейтральны (рН ≈ 7). Например:
NaCl = Na 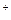 + Cl
+ Cl  ,
,
Nа+ + НОН D реакция практически не идет,
Сl– + НОН D реакция практически не идет,
NаСl + НОН D реакция практически не идет.
Вывод: если соль образована сильным основанием и сильной кислотой, то гидролиз не происходит; растворы таких солей практически нейтральны (рН≈7).
V. Совместный гидролиз двух солей. Рассмотрим, что произойдет при сливании растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а другая сильным основанием и слабой кислотой. Например, при сливании растворов FeCl3 и Na2CО3:
2FеСl3 + 3Nа2СО3 + 6Н2О = 2Fе(ОН)3 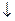 + 3Н2СО3 + 6NаСl
+ 3Н2СО3 + 6NаСl
I ступень:
Fе3+ + НОН D FеОН2+ + Н+,

СО32– + НОН D НСО3– + ОН–
 и т.д.
и т.д.
Образующиеся ионы Н+ и ОН– будут нейтрализовать друг друга, связываясь в молекулы слабого электролита воды, гидролиз обоих ионов усиливается, что приводит к протеканию всех ступеней гидролиза и образованию конечных продуктов Fе(ОН)3 и Н2СО3. Суммарное ионно-молекулярное уравнение:
2Fе3+ + 3СО32– + 6Н2О = 2Fе(ОН)3↓ + 3Н2СО3.
Если учесть разложение Н2СО3 на Н2О и СО2, то окончательные молекулярное и суммарное ионно-молекулярное уравнения будут иметь вид:
2FеСl3 + 3Nа2СО3 + 3Н2О = 2Fе(ОН)3↓ + 3СО2↑ + 6NаСl,
2Fе3+ + 3СО32– + 3Н2О = 2Fе(ОН)3↓ + 3СО2↑.
В осадок в подобных случаях выпадает наименее растворимый из возможных продуктов гидролиза. Так, растворимость карбоната гидроксомеди (СuОН)2СО3 меньше, чем гидроксида меди Сu(ОН)2. Поэтому при сливании растворов СuSО4 и Nа2СО3 конечным продуктом гидролиза является именно (СuОН)2СО3:
2СuSО4 + 2Nа2СО3 + Н2О = (СuОН)2СО3↓ + СО2↑ + 2Nа2SО4,
2Сu2+ + 2СО32– + Н2О = (СuОН)2СО3↓ + СО2↑.
Вывод: если в растворе присутствуют две соли, одна из которых гидролизуется по аниону, другая по катиону, то гидролиз обеих солей усиливается, протекает необратимо с образованием конечных продуктов (слабого основания и слабой кислоты). Растворы таких солей имеют среду, близкую к нейтральной (рН ≈ 7).
VI. Существенно отличен характер гидролиза ковалентных соединений. Большинство соединений неметаллов с неметаллами в воде претерпевает необратимое гидролитическое разложение, например:
SiCl4 + 3HOH = H2SiO3 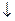 + 4HCl,
+ 4HCl,
SiS2 + 3HOH = H2SiO3 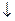 + 2H2S.
+ 2H2S.
Количественные характеристики процесса гидролиза.Количественно гидролиз характеризуется степенью гидролиза h и константой гидролиза Кг.
Степень гидролиза представляет собой отношение числа молекул Nг, подвергшихся гидролизу, к общему числу растворенных молекул Nо, которое определяется концентрацией вещества:
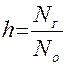 .
.
Степень гидролиза соли, как правило, невелика, зависит от константы гидролиза и концентрации соли и выражается в процентах или долях единицы.
Так, в 0,1 м СН3СООNа и NН4Сl при 298 К она составляет примерно 10–4, т.е. в этих растворах гидролизована лишь одна из 10 000 молекул. Причина столь низкой степени гидролиза кроется в том, что один из участников реакции – вода является очень слабым электролитом. Поэтому положение равновесия реакции гидролиза сильно смещено в сторону исходных веществ.
Более конкретной характеристикой является константа гидролиза. Запишем уравнение гидролиза соли КА (здесь К+ - катион металла, А– - анион кислотного остатка) в общем виде:
КА + НОН D НА + КОН.
Этому равновесию отвечает константа равновесия:
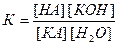 .
.
Концентрация воды в разбавленных растворах представляет собою практически постоянную величину. Обозначая К[Н2О]=Кг, получим:
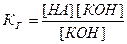 .
.
Величина Кг называется константой гидролиза соли. Ее значение характеризует способность данной соли подвергаться гидролизу; чем больше Кг, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз.
Например, для реакции гидролиза цианида калия
КСN + Н2О D КОН + НСN
или в ионно-молекулярном виде
CN  + HOH D HCN +OH
+ HOH D HCN +OH  ,
,
выражение для константы гидролиза будет иметь вид
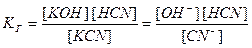 .
.
Выразим из выражения для ионного произведения воды Кв концентрацию гидроксид-ионов: [ОН ˉ] = Кв/ [H+]. Подставим это соотношение в предыдущее выражение для КГ:
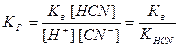 .
.
По этой формуле мы можем вычислить Кг цианида калия, воспользовавшись значением константы диссоциации синильной кислоты:
 .
.
Таким образом, если соль образована слабой кислотой и сильным основанием, константа гидролиза связана с константой диссоциации кислоты Кдкисл зависимостью
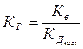 , где Кв- ионное произведение воды.
, где Кв- ионное произведение воды.
Это уравнение показывает, что Кг тем больше, чем меньше Кдкисл. Иными словами, чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли.
Для солей, образованных слабым основанием и сильной кислотой, аналогичное соотношение связывает константу гидролиза с константой диссоциации основания Кдосн:
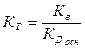 .
.
Поэтому чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза связана с константами диссоциации кислоты и основания следующим соотношением:
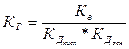 .
.
Эти уравнения служат количественным подтверждением вывода: чем слабее кислота (основание), соль которой (которого) подвергается гидролизу, тем полнее он протекает.
Константа гидролиза связана со степенью гидролиза h уравнением, аналогичным закону разбавления Оствальда для диссоциации слабого электролита:
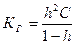 ,
,
где С – молярная концентрация соли в растворе.
Чаще всего гидролизованная часть соли очень мала, а концентрация продуктов гидролиза незначительна. В подобных случаях h<<1, и в знаменателе последней формулы этой величиной можно пренебречь. Тогда связь между Кг и h выразится более простыми соотношениями:
Кг = h2C или 
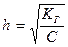 .
.
Из последнего уравнения следует, что степень гидролиза данной соли тем больше, чем меньше ее концентрация; иначе говоря, при разбавлении раствора гидролизующейся соли степень ее гидролиза возрастает.
Влияние различных факторов на глубину процесса гидролиза. На глубину гидролиза, как на обратимый процесс, влияют следующие факторы:
1. Природа соли.
Природа соли проявляется в величине константы гидролиза.
2. Концентрация раствора.
Из последнего уравнения следует, что степень гидролиза данной соли тем больше, чем меньше ее концентрация; иначе говоря, при разбавлении раствора гидролизующейся соли степень ее гидролиза возрастает. Например, уменьшение концентрации раствора Nа2СО3 от 0,1 до 0,001 моль/л при 298 К приводит к увеличению степени гидролиза от 0,029 до 0,34.
Рассмотрим влияние концентрации раствора на глубину гидролиза ацетата натрия. В растворе устанавливается равновесие
СН3СООNа + Н2О D СН3СООН + NаОН,
которому отвечает константа:
 .
.
При разбавлении раствора и увеличении в нем относительной концентрации воды в соответствии с принципом Ле Шателье происходит смещения равновесия в сторону прямой реакции, т.е. гидролиз усиливается (увеличивается h – степень гидролиза).
Разбавим раствор в 10 раз. В первый момент концентрации всех веществ – СН3СООNа, СН3СООН и NаОН – уменьшаются в 10 раз. Вследствие этого числитель правой части уравнения константы гидролиза уменьшится в 100 раз, а знаменатель - в 10 раз. Но Кг, как всякая константа равновесия, не зависит от концентрации веществ. Поэтому равновесие нарушится. Для того чтобы оно установилось, числитель дроби должен возрасти, а знаменатель – уменьшиться, т.е. некоторое количество соли должно дополнительно гидролизоваться. В результате этого концентрации СН3СООН и NаОН возрастут, а концентрация СН3СООNа – уменьшится. Таким образом, степень гидролиза h увеличится.
3. Температура раствора.
Поскольку обратный гидролизу процесс – реакция нейтрализации протекает с выделением теплоты, то реакция гидролиза представляет собой эндотермический процесс (∆Н > 0). Согласно принципу Ле Шателье повышение температуры ведет к усилению гидролиза, а понижение температуры – к его ослаблению.
4. Введение в раствор кислоты или основания.
Подавлению гидролиза способствует введение в раствор одного из продуктов гидролиза (кислоты или основания). Для усиления гидролиза надо сделать все наоборот.
Итак, максимальная степень гидролиза достигается при высоких температурах и в разбавленных растворах.
Напротив, для уменьшения степени гидролиза необходимо использовать возможно более концентрированные растворы солей при низких температурах, а также добавлять к раствору один из продуктов гидролиза: кислоту или щелочь.
| <== предыдущая страница | | | следующая страница ==> |
| Катионы | | | Комплексные соединения. Комплексными называют соединения, в узлах кристаллов которых находятся комплексы (комплексные ионы) |
Дата добавления: 2014-09-29; просмотров: 340; Нарушение авторских прав

Мы поможем в написании ваших работ!