
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
эндоплазматическая сеть
|
Читайте также: |
Рис.24. Активация путей передачи фосфоинозитольного пути
В настоящее время установлено, что гидролиз фосфатидилинозитолов участвует в передаче сигналов более чем от 25 различных рецепторов клеточной поверхности (табл. 12).
Таблица 12
Некоторые клеточные реакции, осуществляемые по фосфоинозитольному пути
| Ткань-мишень | Сигнальная молекула | Главный ответ |
| Печень | Вазопрессин | Распад гликогена |
| Поджелудочная железа | Ацетилхолин | Секреция амилазы |
| Гладкая мускулатура | Ацетилхолин | Сокращение |
| β-клетки поджелудочной железы | Ацетилхолин | Секреция инсулина |
| Тучные клетки | Антиген | Секреция гистамина |
| Тромбоциты | Тромбин | Секреция серотонина и тромбоцитарного фактора роста |
Внутриклеточная система вторичных мессенджеров фосфоинозитольного пути, сопряженная со стимуляцией фосфолипазы Сβ, управляется такими медиаторами и гормонами, как ацетилхолин, серотонин, тиреотропный гормон, а также антигенами, тромбином и др. агонистами. Среди клеточных эффектов, опосредованных действием диацилглицерола и инозитолтрифосфата, можно выделить расщепление гликогена под влиянием возопрессина, сокращение гладких мышц под действием ацетилхолина (мускариновая рецепция), агрегацию тромбоцитов в присутствии тромбина и др.
Активацию фосфолипазы Сγ с образованием ДАГ и ТФИ вызывает тирозинкиназа, цитоплазматический домен которой приобретает способность связывать фосфолипазу при рецепции факторов роста, в частности эпидермального фактора роста.
Образующиеся при гидролизе фосфатидилинозитола молекулы диацилглицерола остаются во внутреннем монослое мембраны, в котором они способны перемещаться путем латеральной диффузии. Здесь же они с помощью мембранного фосфолипида фосфатидилсерина активируют протеинкинаэу С (С-киназу). Последняя переносит концевую фосфатную группу с АТФ на специфические сериновые или треониновые остатки мембранных белков-мишеней и вызывает физиологический ответ. В нейронах, например, С-киназа фосфорилирует ионные каналы, изменяя таким образом возбудимость клеток. Во многих животных клетках она активирует Na+/Н+-обменник плазматической мембраны, контролирующий внутриклеточный уровень рН. Существует мнение, что возникающее в ответ на действие ряда митогенных агентов повышение рН может выступать в качестве фактора, стимулирующего клеточную пролиферацию.
Показано, что диацилглицерол, освобождающийся под действием фосфолипазы С, активирует протеинкиназу С кратковременно. Долговременная стимуляция фермента происходит при активации агонистами фосфолипаз А2 и D, которые обычно гидролизуют основной фосфолипид мембран фосфатидилхолин. Продукты этих реакции способны, в свою очередь, активировать протеинкиназу С. Фосфолипаза А2 расщепляет ФХ до жирной кислоты и лизоФХ, а фосфолипаза D – до фосфатидной кислоты и холина. Фосфатидная кислота далее распадается до диацилглицерола, который и участвует в длительной стимуляции протеинкиназы С.
К субстратам С-киназы относятся белки, участвующие в регуляции клеточного деления, секреции, экзоцитозе, переносе ионов, сокращении гладкой мускулатуры и экспрессии генов. Описано около 10 подтипов протеининкиназы С. Они могут различаться как по тканевой и внутриклеточной локализации, так по субстратной специфичности и механизму регуляции своей активности. Большой интерес представляют протеинкиназы С, участвующие в регуляции экспрессии генов. К их функциям относится активация процессов, приводящих к фосфорилированию ядерного и цитоплазматического факторов транскрипции.
Инозитолтрифосфат, являющийся растворимым продуктом гидролиза фофатидилинозитола, диффундирует из мембраны в цитоплазму, где вызывает высвобождение ионов Са2+ из саркоплазматического ретикулума – внутриклеточного депо кальция. Считается, что мобилизация ионов Ca2+ из депо происходит в результате открытия Са2+-специфических каналов саркоплазматического ретикулума при связывании с ними ИТФ. Ионы Са2+ играют роль посредника, регулирующего целый ряд клеточных процессов. Поскольку мобилизация ионов кальция обеспечивается вторичным посредником – ИТФ, Са2+ часто называют третьим посредником.
Для выполнения регуляторной функции необходимо, чтобы концентрация Са2+ в цитоплазме поддерживалась на низком и достаточно стабильном уровне (10-7моль/л). В удалении из цитозоля избытка иона принимают участие разные механизмы и, прежде всего, АТФ-зависимые кальциевые каналы плазматической мембраны, мембран митохондрий и эндоплазматического ретикулума. Повышение концентрации ионов Са2+, запускающее ту или иную физиологическую реакцию, осуществляется с помощью различных сигнальных механизмов, два из которых в настоящее время хорошо изучены. Это поступление Са2+ через потенциалзависимые каналы при высвобождении нейротрансмиттеров в нервном окончании и выход ионов из каналов эндоплазматического ретикулума под действием инозитолтрифосфата.
Известно два способа действия Са2+ на клеточные белки. Прямой путь заключается в непосредственном связывании ионов Са2+ с белками, обеспечивающими клеточный ответ в результате индуцированного кальцием конформационного изменения. Примером таких белков является регуляторный белок скелетных мышц тропонин С, который, связываясь с ионами Са2+, претерпевает конформационную перестройку, приводящую в конечном счете к сокращению мышцы.
Непрямое действие вторичного мессенджера выражается в активировании протеинкиназ, фосфорилирующих клеточные белки. Этот механизм является общим для различных вторичных посредников. К числу протеинкиназ, активируемых ионами Са2+, относится протенкиназа С. Фермент локализуется преимущественно в цитозоле, но активным становится только тогда, когда связывается с мембраной. Его связывание с внутренним слоем плазматической мембраны происходит в присутствии Са2+, вторичного посредника диацилглицерола с участием фосфатидилсерина.
Са2+-зависимая протеинкиназа другого типа активируется Са2+-кальмодулином. Кальмодулин – регуляторный белок, обладающий способностью, избирательно связывая ионы Са2+, изменять свою конформацию и активировать (или инактивировать) определенные ферменты. Благодаря этому осуществляется влияние иона на многие внутриклеточные процессы. Повышение концентрации ионов Са2+ в цитоплазме, стимулированное ТФИ или другим способом (в результате входа через потенциалуправляемые или лигандуправляемые кальциевые каналы), сопровождается связыванием их молекулами кальмодулина и образованием активного комплекса Са2+-кальмодулин. Образовавшийся активный комплекс активирует протеинкиназу, называемую Са2+/ кальмодулинзависимой протеинкиназой или Са2+/КаМ-киназой, которая фосфорилирует специфические эффекторные протеины, что в конечном счете приводит к разнообразным клеточным ответам. Некоторые Са2+/КаМ-киназы, такие как киназа легких цепей миозина, играющая важную роль в регуляции сокращения гладких мышц, и киназа фосфорилазы действуют только на один клеточный субстрат, тогда как другие полифункциональны и фосфорилируют более чем один субстратный белок. К последним относятся кальмодулинзависимые протеинкиназы, фосфорилирующие многочисленные белки ядра, цитоскелета или мембранные белки. Мультифункциональная Са2+/КаМ-киназа II, сконцентрированная в синапсах, участвует, например, в механизме освобождения нейротрансмиттера из нервного окончания путем экзоцитоза при увеличении в нем концентрации ионов Са2+. Субстратом фермента служит белок синапсин I, фосфорилирование которого вызывает отделение белка от синаптических везикул, позволяющее им выбросить нейротрансмиттер в синаптическую щель.
Среди процессов, контролируемых Са2+, следует выделить функционирование цитоскелета и обеспечение клеточной подвижности. При участии так называемых актинсвязывающих G-белков ионы Са2+ и мембранный фосфолипид фосфатидилтриинозитол регулируют формирование в клетках актиновых сетей и их свойства. При этом взаимодействие актинсвязывающих G-белков с ионами Са2+ усиливает деполимеризацию актиновых филаментов, а с фосфатидилтриинозитолом – их полимеризацию, что в конечном счете сопровождается изменением подвижности клеток и ее формы. К актинсвязывающим G-белкам относится ряд молекул, функции которых сводятся к разделению актиновых филаментов, их разрыву, сшиванию в сети и т.д.
Как уже упоминалось выше, существует ряд агонистов, которые активируют посредством G-белков фосфолипазу А2. Фосфолипаза А2 отделяет от фосфолипидов, а также от вторичного мессенджера диацилглицерола жирную кислоту (обычно ненасыщенную) во втором положении глицерола. Поскольку фосфолипиды и ДАГ во втором положении часто содержат арахидоновую кислоту, в клетке под влиянием фосфолипазы А2 может освободиться значительное количество этого продукта реакции. Арахидоновая кислота служит предшественником для внутриклеточного синтеза простагландинов, простациклинов, тромбоксанов и лейкотриенов, относящихся к классу регуляторных молекул.
Большинство клеточных реакций, опосредованных связыванием рецепторов с G-белками, осуществляется при участии протеинкиназ. Вместе с тем, в некоторых рецепторах вторичные мессенджеры, чтобы вызвать ответ, воздействуют непосредственно на ионный канал. К числу важнейших рецепторов, у которых в передачу сигнала вовлечены ионные каналы, относятся обонятельные и зрительные рецепторы. Многие пахучие вещества, взаимодействуя с рецепторами ольфакторной клетки, активируют Golf-гетеротримерный белок, который, в свою очередь, стимулирует аденилатциклазу. Повышение уровня цАМФ вызывает активирование цАМФ-зависимых Na+-каналов в плазматической мембране ольфакторной рецепторной клетки и ее деполяризацию.
В фоторецепторных клетках мишенью для G-белков является фосфодиэстераза, активирование которой сопровождается расщеплением цГМФ, служащего в этих клетках вторичным мессенджером, до ГМФ. Здесь в качестве первичного сигнала выступает свет, а рецептором для него служит пигмент родопсин, локализованный в наружных сегментах палочек сетчатки глаза (рис.25). Родопсин – это интегрированный в мембрану дисков палочек гликопротеид, состоящий из белковой части (опсина) и связанного с ней хромофора ретиналя.
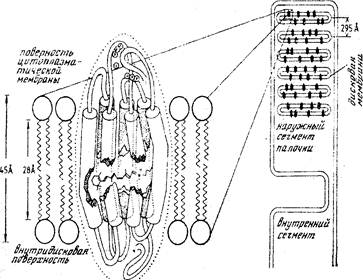
Рис.25. Родопсиновый рецептор палочек сетчатки глаза
В темноте уровень цГМФ в палочках сетчатки глаза высок, поэтому цГМФ-активируемые Na+ в плазматической мембране открыты и поступающие в клетки ионы Na+ поддерживают их деполяризованное состояние (рис.26).
Поглощение родопсином фотона света в диапазоне длин волн 400-600 нм сопровождается изомеризацией ретиналя, дестабилизацией родопсинового комплекса и его гидролизом до ретиналя и опсина. Белок при этом претерпевает ряд конформационных превращений и активирует G-белок, называемый в фоторецепторных клетках трансдуцином (Gt), который стимулирует цГМФ-фосфодиэстеразу с помощью своей α-субъединицы (βγ-комплекс активирует фосфолипазу А2).
Уменьшение концентрации цГМФ под действием фосфодиэстеразы в цитоплазме фоторецепторов приводит к закрыванию цГМФ-зависимого ионного канала плазматической мембраны, что приводит к ее гиперполяризации и генерации нервного импульса.
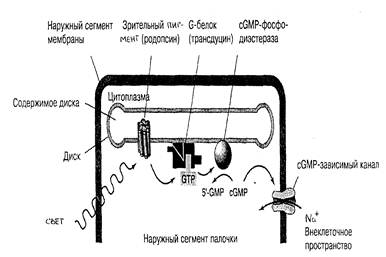
Рис.26. Перенос сигнала в палочках сетчатки глаза
Итак, все про- и эукариотические клетки экспрессируют рецепторные молекулы, обеспечивающие их взаимодействие с окружающей средой, а у многоклеточных организмов - и обмен всех клеток различной информацией. Характерный для каждого конкретного типа клеток набор рецепторов участвует в связывании специфического сигнала, передаче информации внутрь клетки и запуске каскада ферментативных реакций, вызывающих клеточный ответ. При этом клетка отвечает лишь на тот сигнал, для которого у нее имеется рецептор, но различные клетки могут по-разному реагировать на один и тот же лиганд.
В клетках млекопитающих существует множество способов передачи и переработки полученной информации. Рецепторы, интегрированные в мембраны, могут быть сопряжены с G-белками; работать как каналы; иметь домены с собственной ферментативной активностью.
При появлении многоклеточных организмов сформировались особые рецепторы, обеспечивающие объединение клеток в ткани в эмбриональном периоде и поддержание их стабильности у взрослого организма. У животных благодаря адгезивным взаимодействиям осуществляются не только контакты между соседними клетками, но и их связывание с внеклеточным матриксом. Набор рецепторов изменяется при дифференцировке клеток и в процессе развития организма.
Несмотря на то, что рецепторы, ответственные за выполнение определенной функции отличаются высокой специфичностью, разнообразные рецепторные системы имеют в своей основе много общего.
Заключение
Бактериальные, растительные и животные клетки окружены плазматической мембраной – универсальной для всех живых клеток структурой, обеспечивающей их автономное существование. Эукариотические клетки, кроме того, поделены на морфологически различимые, отгороженные мембранами компартменты или органеллы. Ядро, эндоплазматическая сеть, аппарат Гольджи, митохондрии, хлоропласты, эндосомы, лизосомы и пероксисомы представляют собой функционально специализированные индивидуальные внутриклеточные компартменты со своим собственным набором ферментов и других макромолекул, отделенные от остальной части клетки одной или двумя мембранами. В общей сложности у эукариотических клеток внутренние мембраны замыкают в отдельные внутриклеточные компартменты около половины общего объема клетки.
При всем многообразии клеточных мембран химический состав и общие принципы их молекулярной организации по сути одинаковы. Согласно жидкостно-мозаичной модели мембраны образованы фосфолипидным бислоем, с которым связаны периферические и трансмембранные белки. Благодаря нековалентным взаимодействиям между липидами и белками поддерживается структурная целостность мембран. В то же время биологические мембраны являются подвижными, текучими структурами и большинство входящих в их состав молекул способны перемещаться в плоскости мембраны. Текучесть бислоя имеет важное биологическое значение, от нее зависит ферментативная активность мембраносвязанных белков, трансмембранный транспорт и другие функции.
Мембранные белки обеспечивают метаболическую активность внутриклеточных компартментов, работу транспортных и рецепторных систем, тогда как липидный бислой является структурной основой всех мембран, создающей относительно непроницаемый барьер для большинства водорастворимых молекул. Многие мембраны кроме основных компонентов содержат олигосахариды, ковалентно связанные с белками или липидами.
Хотя в целом биомембраны обладают удивительным сходством, высокая степень специализации мембранных клеточных органелл подразумевает наличие определенных структурных особенностей и вариабельность их свойств. При этом кажый из типов мембран характеризуется как общими для любых мембран свойствами, так и чертами, обусловленными выполнением ими специфических функций. Плазматическая мембрана и внутриклеточные мембранные системы могут существенно различаться по соотношению белков, липидов и углеводов; отдельным мембранам присущи определенные химические компоненты, минорные липиды. Наибольшим разнообразием, как было продемонстрировано выше, отличается состав белков, поскольку именно они играют центральную роль в выполнении мембранами тех или иных функций.
Мембраны живых клеток – это не просто пассивные барьеры, разграничивающие отдельные клетки и ее компартменты. Мембранами обеспечивается взаимодействие клеток между собой и внешней средой, необходимое для поддержания жизни функционирующего организма. Межклеточная коммуникация и передача в клетки информации из окружающей среды осуществляются благодаря транспортной и рецепторной функций биомембран. Мембранные системы, опосредующие перенос веществ в клетку и преобразование поступающих сигналов, тесно взаимосвязаны. В одних тканях, например в возбудимых, рецепторы и ионные каналы совместно участвуют в превращении внешних стимулов в электрические сигналы. В других тканях сопряжение рецепции гормонов, трофических и митогенных факторов с транспортными ферментными механизмами или специфическим эндоцитозом реализуется в клеточном росте, движении, метаболических реакциях. Существование сложной цепи взаимодействий в системе передачи сигнала и транспорта веществ позволяет мембранам участвовать в регуляции и координации внутриклеточных биохимических и физиологических процессов, а также обеспечивать адаптацию клеток к постоянно меняющимся условиям окружающей среды.
Литература
1. Албертис Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки: В 3 т. М, 1994
2.Артюхов В.Г., Ковалева ТА., Шмелев В.П. Биофизика. Воронеж, 1994
3.Биологические мембраны. Методы. М., 1990
4. Биохимия мембран (серии 1-9). М., 1986-1991
5. Болдырев А.А. Введение в мембранологию. М., 1990
6. Болдырев А.А. Na/K-АТФаза - свойства и биологическая роль // Соросовский образовательный журнал. 1998. №4.С.2-9
7. Геннис Р. Биомембраны. М., 1997
8. Заварзин А.А., Харазова А.Д., Молитвин М.Н. Биология клетки. Общая цитология. Санкт-Петербург. 1992
9. Кагава Я. Биомембраны. М., 1985
10. Котык А., Яначек К. Мембранный транспорт. М., 1980
11. Марри Р, Греннер Д, Мейес П, Родуэлл В. Биохимия человека: В 2 т. М., 1993
12. Фаллер Д.М.,Шилдс Д. Молекулярная биология клетки. М., 2003
13. Физиология человека /под ред. Шмидта Р., Тевса Г.: В 3 т. М., 1996
14. Филиппов П.П. Как внешние сигналы передаются внутрь клетки //Соросовский образовательный журнал. 1998.№3.С.28-34
15. Фундаментальная и клиническая физиология /под ред. Камкина А.Г. и Каменского А.А. М., 2004
16. Хухо Ф. Нейрохимия. М., 1990
17. Чизмаджиев Ю.А. Мембранная биология: от липидных бислоев до молекулярных машин //Соросовский образовательный журнал.2000. №8.С.12-17
18. Эккерт Р., Рэнделл Д., Огастин Дж. Физиология животных: В 2 т. М., 1991
| <== предыдущая страница | | | следующая страница ==> |
| Сигналы, опосредующие свое действие через ц-АМФ | | |
Дата добавления: 2014-10-02; просмотров: 488; Нарушение авторских прав

Мы поможем в написании ваших работ!