
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Химия как предмет естествознания
Химия изучает ту форму движения материи, в которой происходит взаимодействие атомов с образованием новых определенных веществ.Химия-наука о оставе,строении и свойствах веществ, их превращении или явлениях, кот.эти превращения сопровождают.Современная химия включает:общую, органическую,коллоидную,аналитическую,физическую,геологическую,биохимию,химию строительных материалов.Предмет химии — химические элементы и их соединения, а также закономерности, которым подчиняются различные химические реакции. соединяет физико-математические и биолого-социальные науки.
2.Класс неорганических соединений. Основные химические свойства кислот, оснований, солей.
По свойствам неорганических соединений разделяеют на след. Классы: оксиды, основания, кислоты, соли.Оксиды-соединение элементов с кислородом, в которых последний является более электроотрицательным элементом, а именно проявляет степень окисления -2. и имеет место связь только элемент О2.Общ.формула СхОу. Бывают:кислотные-способны к солеобразованию с основными оксидами и основаниями (SO3+Na2O=Na2SO4; So3+2NaOH=Na2SO4=H2O),основные-способны к солеобразовнию с кислотными оксидами и кислотами(СаО+СО2=СаСО3; СаО+2НСl=CaCl2+H2O ),амфотерные(к-ты и основ.)и с тем и с тем(ZnO,BeO,Cr2O3,SnO,PbO,MnO2).и несолеобразующие(CO,NO,N2O)Основания - вещества, при электролтической диссоциации которых анион м.б. только гидроксильная группа ОН. Кислотность основания-число ионов ОН образующихся при диссоциации гидроксида. Гидроксиды-вещества, содержащие группу ОН, получаются соединением оксидов с водой.Бывают 3видов: основные( основания) ,кислотные (кислородсодержащие кислоты) и амфотерные(амфолиты-проявляют основные и кислотные свойства Cr(OH)3,Zn(OH)2,Be(OH)2,Al(OH)3) Кислоты-вещества, при электролитической диссоциации кот. Катионом м.б. только + заряженный ион Н. Бывают: бескислородные,кислородсодержащие.Число Н-основность кислоты. мета и орто формы-молекулы воды. Соли—вещества, при электоролитической диссоциации которых катионом может быть ион аммония(NH4) или ион металла, а анионом любой кислотный остаток Бывают:средние(полное замещение.состоят из кисотного остатка и иона метала), кислые(неполное замещение.наличие в составе незамещенных Н), основные (неполное замещение.наличие незамещенных ОН) По составу неорганические вещества делятся на бинарные – состоящие только из двух элементов, и многоэлементные – состоящие из нескольких элементов.
3.Основные положения атомно-молекулярного учения
.1.Все вещества состоят из молекул(корпускулы), при физических явлениях, молекулы сохраняются, при химических разрушаются.
2.Молекулы состоят из атомов(элементы), при химических реакциях атомы сохраняются.
3.Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида.
4. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
5.Химичские реакции заключаются в образовании новых веществ, из тех же самых атомов, из которых состоят первоначальные вещества.+6.молек. и атомы находятся в непрерывном движении, а теплота состоит во внутреннем движении этих частиц
. Атом - наименьшая частица элемента, сохраняющая его химические свойства. Атомы различаются зарядами ядер, массой и размерами
Химический элемент - вид атомов с одинаково полож. Зарядом ядра. Физических свойств, характерных для простого вещества, химическому элементу приписать нельзя. Простые вещества - это вещества, состоящие из атомов одного и того же химического элемента.
4.Основные законы химии(закон сохранения, постоянства состава,кратных отношений, закон Авагадро)
Закон сохранения: Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции.
Закон постоянства состава: (любое хим. Соединение имеет один и тот же количественный состав независимо от способа его получения)Соотношения между массами элементов, входящих в сотав данного соединения,постоянны и не зависят от способа получения этого соединения.
Закон кратных отношений: Если два элемента образут друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Закон Авогадро. В равных объемах любых газов, взятых при одной и той же температуре при одинаковом давлении, содержится одно и то же число молекул.
5. Закон Эквивалентов.
Эквивалент вещества- это такое количество вещества,какое взаимодействует с 1 молем атома водорода или вытесняет такое же количество атомов Н в хим. Реакций. Vэ(Л/Моль)- эквивалентный объем вещества, тоесть то объем одного эквивалента вещества в газообразном состояние.ЗАКОН.Все вещества реагируют в химических реакциях и образуются в эквивалентных количествах.
Отношение эквивалентных масс, объемов, реагирующих или образующих вещества,прямо пропорционально отнощению их масс(объемов)
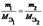 или
или 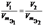 или
или 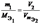
Э(простые)=А(атомная масса)/В(валентность элемента)
Э(кислоты)=М(молярная масса)/осн(основание кислоты)
Э(Гидроксида)=М/Кисл)Кислотность гидроксида)
Э(аксиды соли)=M/а(количество атомов элемента образ. Оксид(соли)*в (валентность этого элемента или металла)
6. Строение атомов. Ядро. Ядерные реакции. Виды излучения.
Модель по резерфорду:1.практически вся масса сосредоточена в ядре 2.+ компенисруются – 3.заряд равен номеру группы. Простейшим –Н водород
Современное понятие хим. Элемента-вид атомов с одинаково полож. Зарядом ядра
атом состоит из положительно заряженного ядра и электронной оболочки.
Электронная оболочка образована электронами. Число электронов равно числу протонов, поэтому заряд атома в целом равен 0 Число протонов, заряд ядра и число электронов численно равны порядковому номеру химического элемента.
практически вся масса атома сосредоточена в ядре.
Электроны двигаются вокруг ядра атома, не беспорядочно, а в зависимости от энергии, которой они обладают, образуя так называемый электронный слой.
На каждом электронном слое может располагаться определенное число электронов: на первом — не больше 2, на втором — не больше 8, на третьем — не больше 18.
Число электронных слоев определяется по номеру периода
Число электронов на последнем (внешнем) слое определяется по номеру группы
в периоде происходит постепенное ослабление металлических свойств и возрастание свойств неметаллов
Я́дерная реа́кция — процесс образования новых ядер или частиц при столкновениях ядер или частиц. Радиоактивностью называют самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопроваждающееся испусканием элементарных частиц или ядер.
Виды излучений:альфа,бета(отриц и полож) и гамма.
Алфа частица – ядро атома гелия 4/2He. При испускании альфа-частиц ядро теряет два протона и два нейтрона,следовательно заряд уменьшается на 2, а массовое число на 4.
отрицательная бэта частица – электрон . при испускании электрона заряд ядра увеличивается на единицу, а массовое число не изменяется.
нестабильный изотоп оказывается настолько возбужденным, что испускание частицы не приводит к полному снятию возбуждения, тогда он выбрасывает порцию чистой энергии, называемой гамма-излучением.
Атомы обладающие одинаковы зарядом ядра, но разными массовыми числами, называются изотопами(например 35/17 Cl и 37/17Cl)
Атомы имеющие одинаковые массовые числа,но разное число протонов в
ядре,называются изобарами(например 40/19K и 40/20Ca)
Периодом полураспада (Т ½ )называется время,за которое распадается половина исходного количества радиоактивного изотопа.
7. Квантовые числа.
Состояние электрона в атоме описывают с помощью4 квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые 3 характеризуют движение электрона в пространстве, а 4 - вокруг собственной оси.Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. 1.Главное квaнтовое число n определяет общую энергию электрона , энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака; принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .) Из пс для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является внешним 2Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, ..n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l= 0 называются s-орбиталями, l =1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l=2 – d (5 типов), l=3 – f- (7 типов). 3Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. на s- подуровне - одна, на p- подуровне - три, на d- подуровне - пять, на f- подуровне - 7 орбиталей. 4Спиновое квантовое число s характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и -1/2 соответствующие противоположным направлениям вращения. соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином Для обозначения электронов с различными спинами используются символы: стрелки.
8. Принцип Паули. Принципы заполнения орбиталей.
В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами Два электрона, находящиеся на одной орбитали и обладающие противоположно направленными спинами, называются спаренными,в отличие от одиночного лектрона, занимающего другую орбиталь. Наиболее устойчивое состояние электрона в атоме соответствует минимальному возможному значению его энергии.
9. Правило Гунда(хунда)
Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Отметим что правило Хунда не запрещает ругого распределения электронов в пределах подуровня. Оно лишь утверждает, что максимальное значение суммарного спина атома соответствует устойчивому,т .е. невозбужденному состоянию, в котором атом обладает наименьшей возможной энергией; При любом другом распределении электронов энергия атома будет иметь большее значение, так что он будет находиться в возбужденном, неустойчивм состояние.
10. Правило Клечковского
(принцип наименьшей энергии). В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду:
1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d " 4f < 6p < 7s.
11. Переодический закон Д.И.Менделеева
1.формулировка. Свойства атомов и образованных ими соединений находятся в периодической зависимости от атомных весов этих соединений
2 формулировка. Свойства атомов и образованных ими соединений находятся в периодической зависимости от заряда ядра атома
Менделеев формулировал: Свойства протых тел,а так же формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Изменение свойств химических элементов по мере возрастания их атомной массы не совершается непреывно в одном и том же направлении,а имеет периодический характер.
12. Структура периодичекой системы.
состоит из девяти горизонтальных рядов и восьми вертикальных столбцов,или групп, в которых один под другим размещены сходные между собой элементы.
Распространённее других являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.
13. Химическая связь. Виды химической связи.
Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
Химическая связь возникает благодаря взаимодействию электрический полей,создаваемых электронами и ядрами атомов, учавствующих в образовании молекулы или кристалла. виды : метталическая,ионная,ковалентная,водородная, донорно-акцепторная.Донорно-акцепторная (координационная связь) —связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора).Металлическая связь — связь, обусловленная свободными электронами. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.Водородная связь — разновидность донорно-акцепторной связи, невалентное взаимодействие между атомом водорода H, и электроотрицательным атомом B другой молекулы. Характерны не очень высокая прочность, её распространенность и важность, особенно в органических соединениях, а также некоторые побочные эффекты, связанные с малыми размерами и тсутствием дополнительных электронов у водорода
14 Ионная связь
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы. Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы окружённые диполями растворителя.
Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона).
15. Ковалентная связь
Ковалентная связь (атомная связь, гомеополярная связь) —наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору)
электронные облака (электроны) называются общей электронной парой
Характерные свойства— направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловливает молекулярное строение веществ и геометрическую форму их молекул.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Электроны тем подвижнее, чем дальше они находятся от ядер.
16. Межмолекулярное взаимодействие.
Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. Впервые Я. Д. Ван-дер-Ваальсом в 1873 году. Межмолекулярное взаимодействие имеет электрическую природу и складывается из сил притяжения (ориентационных, индукционных и дисперсионных) и сил отталкивания.
Ориентационная сила возникает благодаря тому, что расстояния между разноименными зарядами немного меньше, чем между одноименными. В результате притяжение диполей превосходит их отталкивание. Взаимодействие диполей зависит от их взаимной ориентации. Индукционные силы действуют между полярной и неполярной молекулами. Полярная молекула создает электрическое поле, которое поляризует молекулу с электрическими зарядами, равномерно распределенными по объему. Положительные заряды смещаются по направлению электрического поля, а отрицательные – против. В результате у неполярной молекулы индуцируется дипольный момент.
Между полярными молекулами действует дисперсионное межмолекулярное взаимодействие. В атомах и молекулах электроны сложным образом движутся вокруг ядер. В среднем по времени дипольные моменты неполярных молекул оказываются равными нулю. Но в каждый момент электроны занимают какое-то положение. Поэтому мгновенное значение дипольного момента отлично от нуля. Мгновенный диполь создает электрическое поле, поляризующее соседние молекулы. В результате возникает взаимодействие мгновенных диполей. Силы отталкивания действуют между молекулами на очень малых расстояниях, когда приходят в соприкосновение заполненные электронные оболочки атомов, входящие в состав молекул. Возникающие при этом силы отталкивания зависят от индивидуальности молекул.
17. Комплексные соединения. Классификация
Комплексные соединения – определенные химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так и в растворенном состоянии. Согласно координационной теории вернера в центре комплексного соединения расположен коплексообразователь или центральный ион, как правило +заряженный. Чаще всего это металлы 6 и 8 групп. Вокруг комплексообразователя расположены лиганды .Ими могут быть «-» заряжен. Частички и электронейтральные молекулы. Число сигма связывающее между комплексообразователем и лигандами наз-ся координационным числом. Вмсете комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения. Она заключена в [ ]в зависимости от заряда внутренней сферы различают 3 типа комплексных соединений: 1.если внутр сфера заряжена + -это соединение катионного типа 2.если внутр. сфера «-» зяряжена, то это соединение анионного типа.3. если заряд равен 0.электронейтрального типа.
За пределами внутренней сферы расположенена внешняя сфера(в электронейтральном типе отсутствует)
По числу связей, образуемых лигандом с комплексообразователем, лиганды делятся на моно-, ди-, и поле дентатные лиганды.
18. Элементы химической термодинамики
Химическая термодинамика отвечает на 2 вопроса:
1. Сколько тепла выделяется/поглощается в ходе химической реакции.
Любая реакция протекает с изменением внутренней энергии:
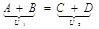
1) ΔU=U2-U1 <0-выделилось тепло (экзотермические реакции)
2) U1<U2: ΔU=U2-U1 >0-поглотилось тепло (эндотермические реакции). В химии большинство реакций протекает при постоянном давлении. Вместо понятия «внутренняя энергия» в химии употребляется «энтропия» (теплосодержание) - Н, кДж
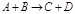
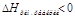 - тепло выделилось
- тепло выделилось
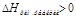 - тепло поглотилось
- тепло поглотилось
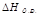 - изменение энтропии при протекании химической реакции или тепловой эффект реакции.
- изменение энтропии при протекании химической реакции или тепловой эффект реакции.
2. Может ли вообще протекать та или иная реакция. Существует 2 фактора:
1. Раньше считалось, что самопроизвольно могут протекать экзотермические реакции. 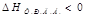 - энтропийный фактор
- энтропийный фактор
2. Позже обнаружен ряд реакций, протекающих с поглощением тепла. NANO2 раств. 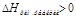
Энтропия S- мера неупорядоченности системы
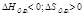
| ΔG<0 при любой Т |
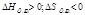
| ΔG>0 при любой Т р-я не идет |
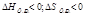
| ΔG<0 при небольших Т |
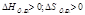
| ΔG<0 при больших Т |
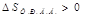
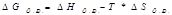
Реакции идут, если ΔG<0; Т-температура в Кельвинах
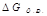 - энергия Гиббса//свободная энергия реакции.
- энергия Гиббса//свободная энергия реакции.
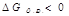 - реакция идет
- реакция идет
 - реакция не идет
- реакция не идет
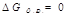 - состояние равновесия
- состояние равновесия
19. Закон Гесса. Следствие из закона Гесса
Тепловой эффект химической реакции, зависит только от начального и конечного сосотояния системы и не зависит от пути перехода
В законе Гесса проявляется свойство внутренней энергии системы как функции состояния, т.е. параметра зависящего только от начального и конечного состояния системы.Внутрення энергия зависит:1.от состава2.количества в-ва
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).
Следствия из закона Гесса:
1) Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье – Лапласа).
2) Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты.
3) Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты.
4) Если начальное и конечное состояние химической реакции совпадают, то ее тепловой эффект равен нулю.
20. Скорость гомогенной хим. Реакции
Называют изменение количества вещества в единицу времени в еденице объема
Гомогенной(однородной) называют системы, в кот. Отсутствуеют поверхность раздела между ее составляющими.Перемешивание компонентов системы происходит на молекулярнои или ионно-молекулярном уровне
При постоянном объеме: скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ за единицу времени.
21. Скорость гетерогенной хим. реакции
Называют изменение количества вещества на единице площади раздела фаз
Гетерогенной называют систему, в кот. Имеет место поверхность раздела между отдельными ее составляющими. Поверхность раздела возникает:а)при контакте веществ в разном агрегатном состоянииб)при контакте 2х жидкостей(если они не смешиваются)и всегда 2х твердых веществ
Количество вещества в еденице объема наз-т концентрацией, поэтому для газов и жидких веществ:
Vср=∆c/∆t
22. Факторы влияющие на скорость хим. Реакции Среди всех факторов выделяют 4 основных характерных для большинства видов хим. Процессов: 1. Природа реагирующих веществ(2NO(г)+O2=2NO2(г)быстро , 2СО2(г)+О2(г)=2СО(г)медленно )2.концентрация реагирующих веществ 3.температура проведения реакции 4.наличие или отсутствие катализатора
Влияние температуры на скорость реакции.
Влияние температуры на скорость происходит по правилу вант-гоффа:При повышении температуры на каждые 10град скор. Реакции увеличиы. В среднем в 2-4 раза к(t+˔∆t)/k=V(t+∆t)/V=ɣ^(∆t/10°)
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
Скорость химической реакции очень сильно возрастает при повышении температуры. Это связано с тем, что элементарный акт химической реакции протекает не при всяком столкновении реагирующих молекул: реагируют только те молекулы (активные молекулы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных частицах и тем самым создать возможность образования новых молекул. Поэтому каждая реакция характеризуется определенным энергетическим барьером. Для его преодоления необходима энергия активации – некоторая избыточная энергия (по сравнению со средней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового вещества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
23. Обратимые процессы. Химическое равновесие Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях называются обратимыми.Хим. Равновесие. Данное понятие вводится только для обратимых процессов.Условия наступлдения хим равновесия:Vпрямой=VобратнойmA+nB=xC+yD Vпрямой=k1[A]^m*[B]^n Vобратной=k2[C]^x*[D]^y они равныàkравновесия=k1/k2=([C]^x*[D]^y)/( [A]^m*[B]^n) Численное значение kреакции зависит от темп. И не зависит от начальной концентрации веществ. 24. Принцип Ле Шателье. Влияние параметров реакции на смещене равновесия Это принцип противодействия.Формулировка: Если на систему находящуюся в состоянии хим. Равновесия оказать какое либо внешнее воздействие(изменить с,темп.,давл) то хим равновесие сместится так чтобы ослабить внешнее воздействие.
Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия.
1.изменинение концентрации
Если увеличить концентрацию исходных веществ, то протекать будет преимущественно прямая реакция, равновесие сместится вправо - в сторону образования продуктов реакции.
2. изменение температуры реакция м.б. экзотермическая(выделение тепла ∆Н<0) или эндотермич.(поглощение тепла ∆ Н>0)
При увел температыры в сторону эндотермич. Влево. При понижении темп вправо в сторону экзо
3.изменение давления смещает хим. равновесие только в реакциях, идущих с участием газа. И только в том случае, если число моль газов в левой и правой частях уравнения не равно. Если равно то изм.давления не сместит хим. Равновесие. Увеличение давл. в сторону меньшего числа моль. Уменьшение давления в сторону большего.
25. Гомогенный катализ
Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции, протекающие под действием катализаторов, называются каталитическими. Различают гомогенный и гетерогенный катализ.
В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). Бывают катализаторы как ускоряющие протекание реакции, так и замедляющие ее. В первом случае катализ называется положительным, а во втором – отрицательным. Катализаторы, уменьшающие скорость реакции, называются ингибиторами.
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO
H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации(- минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция).
26. Гетерогенный катализ
Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции, протекающие под действием катализаторов, называются каталитическими. Различают гомогенный и гетерогенный катализ.
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного.
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазы.
27. Растворы неэлектролитов, их общие свойства, способы выражения коцентрации
Растворы — это гомогенные смеси , состоящие из растворителя, растворенного вещества и продуктов взаимодействия между ними.
Растворитель-вещество, которое в чистом виде находится в том же агрегатном состоянии, что и раствор. Бывают жидкими газообразными и твердыми.
Растворенное вещество, как правило, меняет агрегатное состояние. Если растворенное вещество и растворитель нах-ся в одном и том же агрегатных состояниях то растворителем является то, которого больше.Вода-всегда растворитель
Сольватация-процесс взаимодейстия растворителя с растворяемым веществом(если это вещество-вода, то наз-ся гидратация)Продукты этого взаимодействия носят названия сольватов и гидратов
Концентрация- колиественная характеристика относительного содержания рстворенного вещества и растворителя в растворе.
Способы выражения концентрации
1) Массовая доля (С,%) – показывает какую часть масса растворенного вещества составляет от массы раствораПроцентное отношение массы растворенного вещества к общей массе раствора;С=m1/mраствора*100, m раствора=pV
2) Мольная доля (Ni) – Отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе.Ni=ѵ1/( ѵ1+ѵ2), ѵ=m/M
3) Молярная концентрация или молярность (СМ или М,моль/л) – показывает сколько молей растворенного вещества содержится в одном литре раствора.Отношение количества растворенного вещества к объему раствора. СМ= ѵ1/V=m1/(M1*V)=m1*ρ/M1*m= (ρ*c*10^3)/М
4) Моляльная концентрация или моляльность (Сm,моль/кг) – определяет количество растворенного вещества, содержащихся в 1 кг. Растворителя. Отношение количества растворенного вещества к массе растворителя. Cm= ѵ2/m2*1000=m1/(M1*m2)*1000=m1/(M1(m-m1))*1000
5) Эквивалентная концентрация или нормальность (СН или н.,моль/л) – Отношение числа эквивалентов растворенного вещества к объему раствора.
CH=nэ/V=m1/(mэ*V)=m1/(M1*Э1*V)=(m1*ρ)/M1*Э1*m
6)титр раствора определяет массу растворенного вещества в граммах, которая содержится в 1 мл раствора. Титр раствора,г/мл, Т=m1/V=Cm*M1/1000=CH*Э1*M1/1000
28. Закон Рауля
Давление пара растворителя над раствором нелетучего компонента всегда ниже, чем давление пара над чистым растворителм.
Рауль установил, что относительное понижение давления пара над раствором равно мольной доле растворенного вещества
(p-p0)/p=N p0-давление пара над раствором, p-давление пара над чистым растворителем//N-мольная доля растворенного вещества
Раствор замерзает при более низкой температуре чем растворитель
Изменение температуры замерзания будет равно к-криоскопической постоянной умнож. На См молярную концентрацию раствора ∆Тзамерз.=к*См
Температура кипения раствора всегда выше, чем у чистого растворителя ∆Ткипения=к*См, к-эбумоскопическая постоянная
Следствия:
1) Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворенного вещества и прямо пропорционально моляльной концентрации раствора.
2) Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворенного вещества и прямо пропорционально моляльной концентрации раствора.
29. Закон Вант-Гоффа. Осмос
диффузия -способностью в-ва распределяться по всему объему. Осмос – переход растворителя из менее концентрированного раствора в более концентрированный раствор вещества. Процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации величина осмотического давления зависит от концентрации раствора и от его температуры, но не зависит ни от природы растворенного вещества, ни от природы растворителя. Для растворов неэлектролитов невысоких концентраций зависимость осмотического давления от концентрации и температуры раствора выражается Закон Вант-Гоффа: Для разбавл. растворов осмотическое давление независимо от рода р-теля и р-ного в-ва при данной температуре пропорциональна молярной концентрации р-ра. Используя осмитич. Давление также можно определить молек. массы р-ных в-в. Pосм=CmRT=nRT/Vр-ра=mр/мр/Vр-ра
Pосм – осмотическое давление раствора, кПа; Cm – его молярная концентрация, моль/л; R – универсальная газовая постоянная, 8,314 Дж/(моль*К); Т – абсолютная температура раствора.
30. Закон Генри. Растворимость.
ГЕНРИ ЗАКОН: растворимость газа при заданной т-ре пропорциональна его давлению над р-ром.
N=k*p,где N-мольная доля растворенного вещества,k-постоянная Генри,p-парциальное давление газа.Закон Генри-частный случай закона распределения:Вещество, способное растворится в 2х несмешивающийся жидкостяхраспределяется между ними так, что концентрация его в этих растворах остается постоянной при данной темпер. С1/с2=к к-коэфф.распределения, с1с2-концентрации веществ
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах.Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
31. Температура кипения и замерзания раствора.
Температура кипения – температура, при которой происходит кипение жидкости, находящейся под постоянным давлением. Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как сама жидкость всегда несколько перегрета относительно температуры кипения.
Разность между температурами кипения раствора и чистого растворителя называют повышением температуры кипения раствора. Разность между температурами замерзания раствора и чистого растворителя называют понижением температуры замерзания раствора. tкип=t’кип-tкип,tзам= t’зам- tзам . Всякая жидкость начинает кипеть при той температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. температура кипения раствора всегда выше температуры кипения чистого растворителя. Аналогично объясняется и понижение температуры замерзания растворов.
Изучая замерзание и кипение растворов, Рауль установил, что для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации раствора: tкип=Em, tзам=Km. Здесь m — мольно-массовая концентрация (моляльность); Е и К — эбуллиоскопическая и криоскопическая постоянные, зависящие только от природы растворителя, по не зависящие от природы растворенного вещества. Раствор кристаллизуется и кипит не при определенной температуре, а в некотором температурном интервале. Температуру начала кристаллизации и начала кипения данного раствора называют его температурой кристаллизации и температурой кипения.
Повышение температуры кипения и понижение температуры замерзания растворов соответствует принципу Ле Шателье.
32. Растворы электролитов. Сильные и слабые электролиты.
Раствор электролита – раствор, который проводит электрический ток вследствие диссоциации на ионы.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ, содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного в-ва. Р-ритель (чистый или смешанный) обычно в сколько-нибудь значит степени не диссоциирован. Растворы электролитов обладают способностью проводить электрич. ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные св-ва бесконечно разбавленных растворов электролитов (т. е. св-ва, зависящие только от концентрации растворенного в-ва, но не от его природы) существенно отличаются от тех же св-в растворов неэлектролитов. Этим, в частности, объясняется увеличение осмотич. давления в сравнении со значением, предсказываемым законом Вант-Гоффа, понижение давления пара р-рителя над р-ром в сравнении с предсказываемым Рауля законом и др. Наличием ионов обусловлены также классификация растворов электролитов, особенности теоретич. подходов в сравнении с др. классами р-ров. Наиб. изучены водные растворы электролитов, играющие важную роль во многих биол., геол. и техн. процессах. Неводные растворы электролитов служат средой для проведения синтеза и электрохим. процессов, используются в совр. технологиях (создание новых химических источников тока, солнечных батарей, процессы разделения в-в и др.).
Исходя из степени диссоциации все электролиты делятся на две группы
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как:HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
33. Водородный показатель
Водородный показатель, pH — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
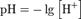
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH-] говорят, что раствор является кислым, а при [OH-] > [H+] — щелочным.
Методы определения значения pH
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы.
34. Гидролиз солей
Гидролиз – разложение водой - взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита.
В процессе гидролизу подвергается ион, входящий в состав слабого электролита.Гидролиз м. Идти по катиону или по аниону
Различают несколько вариантов гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания:
Na2CO3 + Н2О = NaHCO3 + NaOH
CO32- + H2O = HCO3- + OН-
(раствор имеет щелочную среду, реакция протекает обратимо)
2. Гидролиз соли сильной кислоты и слабого основания:
СuСl2 + Н2О = CuOHCl + HCl
Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет кислую среду, реакция протекает обратимо)
3. Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OН)3 + 3H2S
2Аl3+ + 3S2- + 6Н2О = 2Аl(OН)3(осадок) + ЗН2S(газ)
(Гидролиз в этом случае протекает практически полностью, так как оба продукта гидролиза уходят из сферы реакции в виде осадка или газа).
В реакции гидролиза вступают соли, образованные слабой кислотой и слабым основанием, или слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой.
Соль сильной кислоты и сильного основания не подвергается гидролизу, и имеет нейтральную среду.
Растворы солей, образованных слабой кислотой и сильным основанием, имеют щелочную реакцию.(CH3COONa+H2O=CH3COOH+NaOH)
Растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию.(NH4Cl+H2O=NH4OH+HCl)
Чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли.
(Чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли)
Смещение хим.равновесия:1.повышекние температуры усилит,понижение ослабит2.добавление воды усилит3.вещевтва с Н+ подавлятся, с ОН- усилится
35. Дисперсные системы, их классификация
Дисперсная система — это смесь, состоящая как минимум из двух веществ, которые совершенно или практически не смешиваются друг с другом и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Фазы можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
 Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза
Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем.
По кинетическим свойствам дисперсной фазы дисперсные системы можно разделить на два класса:
- Свободнодисперсные системы, у которых дисперсная фаза подвижна;
- Связнодисперсные системы, дисперсионная среда которых твердая, а частицы их дисперсной фазы связаны между собой и не могут свободно перемещаться.
В свою очередь эти системы классифицируются по степени дисперсности.
Системы с одинаковыми по размерам частицами дисперсной фазы называются монодисперсными, а с неодинаковыми по размеру частицами — полидисперсными. Как правило, окружающие нас реальные системы полидисперсны.
| Название | Размер частиц, м |
| Ультрамикрогетерогенные | 10-9-10-7 |
| Микрогетерогенные | 10-7-10-5 |
| Грубодисперсные | более 10-5 |
По размерам частиц свободнодисперсные системы подразделяют на:
Связнодисперсные системы (пористые тела) по классификации М. М. Дубинина подразделяют на:
| Название | Размер частиц, нм |
| Микропористые | менее 2 |
| Переходнопористые | 2-200 |
| Макропористые | более 200 |
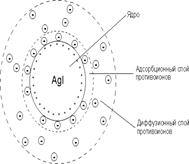
36. Строение мицеллы
Мицеллы — частицы в коллоидных системах, состоят из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкой адсорбированных ионов и молекул растворителя Средний размер мицелл от 10−5 до 10−7см.
К мицеллам относят также частицы в растворах поверхностно-активных веществ (ПАВ), называемых лиофильными коллоидами.
Мицеллы представляют собой скопления правильно расположенных молекул, удерживаемых преимущественно дисперсными силами.
Образование мицелл характерно для водных растворов моющих веществ и некоторых органических красителей с большими молекулами. В других средах, - например в этиловом спирте, - эти вещества растворяются с образованием молекулярных растворов.
37. Кристаллическое и аморфное состояние веществ. Типы кристаллической решетки.
КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ вещества, характеризуется наличием дальнего порядка в расположении частиц (атомов, ионов, молекул). В кристаллическом состоянии существует и ближний порядок, к-рый характеризуется постоянными координац. числами, валентными углами и длинами хим. связей. Инвариантность характеристик ближнего порядка в кристаллическом состоянии приводит к совпадению структурных ячеек при их трансляционном перемещении и образованию трехмерной периодичности структуры Вследствие своей макс. упорядоченности кристаллическое состояние в-ва характеризуется миним. внутр. энергией и является термодинамически равновесным состоянием при данных параметрах -давлении, т-ре, составе (в случае твердых растворов)
АМО́РФНОЕ СОСТОЯ́НИЕ, твердое конденсированное состояние вещества, характеризующееся изотропией физических свойств, обусловленной неупорядоченным расположением атомов и молекул. Кроме изотропии свойств (механических, тепловых, электрических, оптических и т. д.) для аморфного состояния вещества характерно наличие температурного интервала, в котором аморфное вещество при повышении температуры переходит в жидкое состояние. Этот процесс происходит постепенно: при нагревании аморфные вещества в отличие от кристаллических, сначала размягчаются, затем начинают растекаться и, наконец, становятся жидкими, т. е. аморфные вещества плавятся в широком интервале температур.
Кристалли́ческая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла.. В зависимости от типов химической связи между узлами различают следующие типы решёток:1.ионные 2.атомные 3. молекулярные, 4. металлические.
38. Общие свойства металлов. Стандартный электродный потенциал.
Металл – группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность.
Характерные свойства металлов
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы йод и углерод в виде графита) - Хорошая электропроводность - Возможность лёгкой механической обработки (см.: пластичность; однако, некоторые металлы, например германий и висмут, непластичны) - Высокая плотность (обычно металлы тяжелее неметаллов) - Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы) - Большая теплопроводность
- В реакциях всегда являются восстановителями
Химические свойства металлов
1.Взаимодействие Ме с водой. Возможно при выполнении след. Усл. φ°<-0,41В
2.Активный Ме не должен подвергаться посевации. Посевация- свойство акт. Ме самопроизвольно образов. На своей поверхности плотную защитную пленку. По хм. Составу –жто оксид или соль ме, способные к посевации явл цинк и алюминий. Взаимодействие идет по схеме 2Ме +2nH2O=2Me(OH)n+nH2
Me-ne=Me(+n)
2H+2e=H2
3.Взаимодействие с кислотами. Взаимодействие Ме φ°<0 при этом образуется соль Ме и выделяется Н
а) с HCl только Me с φ°<0 независимо от концентрации
2Me +2HCl=2MeCl(n)+nH2
Me-ne=Me(+n)
2H+2e=H2
б)с Н2So4/Восстанавливаться могут Н и S.Какой элемент и до какой степени восстанавл. Зависит от активности Ме и концентрации кислоты.
В)при взаимодействии Ме с НNO3 Никогда не выделяется Н2.Восстанавливается только Н.
Со щелочами взаим. Только амфотерные металлы: Al, Cr, Zn, Be
Взаимодействие Ме с солями.
Возмодно только в том случае если φ° Ме < φ° др. Ме, входящего в виде иона в составе соли.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии.Эту величину определяют эксперементальным путем. Испльзуя установку представляющую собой гальванический элемент, одним электродом кот. Явл. Пластина исследуемого ме, помещенная в раствор соли Ме с концентрацией ионов Ме 1 моль/лàДругим всегда стандартный водородный электрод, кот. Представляет собой пластину с напылением платины, помещенный в 1М раствор H2SO4 и омываемую газообразным водородом. Численным значением φ° приписывают знак + или –В данном случае это означает направление движения е относительно водородного эектрода. «-» от Ме к Н электроду. «+» от Н электрода к Ме. На основании численных значений φ Ме располагают в электрохим. Ряд напряжений.
Чем меньше в алгебраическом смысле знач φ, тем активнее Ме.
39. Методы получения металлов
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов.( Легирование – это введение в расплав дополнительных элементов, модифицирующих механические, физические и химические свойства основного материала.) Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в наших клетках кальция и натрия, сконцентрированного в лимфатических системах. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Существуют несколько основных способов получения металлов.
Восстановление:
— из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом
WO3 + 3H2 =W + 3H2O
 СоО + Н2 = Со + Н2О
СоО + Н2 = Со + Н2О
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем)
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
Электролизом расплавов солей
СuСl2, — Сu2+ 2Сl
Катод (восстановление): Анод (окисление):
Сu2+ 2е- = Сu0 2Cl - 2е- = Сl°2
40. Электролиз. Законы электролиза
Электролиз — физико-химическое явление, состоящее в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, которое возникает при прохождении электрического тока через раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — ионы кислотных остатков и гидроксильной группы — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия , хлора, хлорорганических соединений, диоксида марганца, пероксида водорода.
Электролиз находит применение в очистке сточных В 1832 году Фарадей установил, что масса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду Q, прошедшему через электролит:
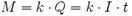
если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Количественные характеристики электролиза выражаются двумя законами Фарадея:
1) Масса вещества, выделяющегося на электроде, прямо пропорциональна количеству электричества, прошедшего через электролит.
2) При электролизе различных химических соединений одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные их электрохимическим эквивалентам.
Эти два закона можно объединить в одном уравнении:
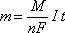 ,
,
где m – масса выделяющегося вещества, г;
n – количество электронов, переносимых в электродном процессе;
F – число Фарадея (F=96485 Кл/моль)
I – сила тока, А;
t – время, с;
M – молярная масса выделяющегося вещества, г/моль.
41. Гальванические элементы
Это устройства ддля преобразования хим.энергии в электрическую
Принцип действия основан на пространственном разделении окислительного и восстановит. Процесса. Электроны от восстановителя окислителю переходят по внешнему проводнику.
Любой гальванический элемент сост. Из 2х электродов: анода и катода
Каждый электрод представляет собой систему, содержащую один и тот же элемент в 2х разных степенях окисления(окисленной и восстановленной формах)
Гальванический элемент Даниэля-Якоби
42. Коррозия металлов
Самопроизвольное разрушение Ме под действием окр. среды, это ОВР, протекающие на пов-ти раздела фаз
По механизму протекания м.б.:-химическая,-электрохимическая
Хим. обусловлена вз-ием Ме с сухими газами или жидкостями, не проводящими эл.ток. Протекает без возникновения тока. (разновидность-газовая коррозия). У некоторых Ме соприкосновение с возд.(газами) замедляет коррозию, т.к. на пов-ти Ме обр-ся защитная оксидная пленка, которая препятствует проникновение к Ме газов и жидкостей. Такой Ме становится пассивным, неактивным(Al, Cr, Zn, пассивным Ме делает конц. HNO3). Примером корр. в неэлектролитах может служить разруш. цилиндров в ДВС за счет серы, содерж. в бензине. S+O2->SO2 – обр-ся агрессивные оксиды
Наиб. вред наносит электрохим. коррозия-процесс разрушения Ме, находящегося в контакте с др. Ме среди электролита(возникнов. гальв. тока)
*место для рисунка*
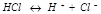 ; pH<7
; pH<7
Анодный процесс: 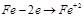
Катодный процесс: водородная диполяризация
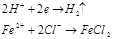
Атмосферная коррозия.
H20, ph=7; среда нейтральная
*место для рисунка*
Анодный процесс: 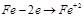
Катодный процесс: 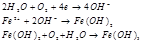
43. Методы защиты металлов от коррозии
1. Лаки, краски, покрытия
2. Электрохимические способы:
А) анодная защита - менее активный Ме покрывает более активный 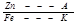
Б) катодная защита – обратна анодной защите
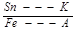
В) протекторная – вариант анодной. Используется для защиты мостов, тоннелей, ж/д путей, линий электропередач
3. создание инертной атмосферы
4. Вакуумирование
5. Использование различных сплавов
44. Сплавы. Основные типы двухкомпонентных диаграмм состояния.
Сплавы делятся на:
- Металлические (только из металлов Cu+Zn – латунь, Fe+C – чугун)
- Неметаллические (Естественные силикаты – гнейс, базальт, гранит; искусственные силикаты – стёкла, шлаки металлического производства, славы солей)
Свойства сплавов зависят от их состава.
Типы: 1. Сплавы не образующие интерметаллические соединения и твёрдых растворов.
2. Сплавы образующие интерметаллические соединения. 3. Сплавы образующие твердые растворы.
Температура сплавов ниже, а прочность а твёрдость выше чем у компонентов их образующих.
Можно получить сплавы с заранее заданными свойствами.
Бронза(медь + олово) Латунь(медь + цинк(35-30%)) Баббиты(олово + свинец) Нихром(никель + хром) Победит(углерод + вольфрам + кобальт(при бурении горных парод)) Сталь(Fe+C(1,7%)) Чугун(Fe+C(>2%))
1. Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью)
2. Диаграмма состояния сплавов с отсутствием растворимости компонентов в компонентов в твердом состоянии (механические смеси)
3. Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
4. Диаграмма состояния сплавов, компоненты которых образуют химические соединения.
5. Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (переменная растворимость)
6. Связь между свойствами сплавов и типом диаграммы состояния.
46. Минеральные вяжущие вещества, и их химический состав.
- материалы, способные при смешивании с Н2О образовать пластичную массу, затвердевающую с течением времени в камневидное тело.
Минеральные вяжущие вещества делятся на воздушные(затвердевают и длительно сохраняют прочность только на воздухе) и гидравлические(затвердевают и длительно сохраняют прочность не только на воздухе, но и в воде).
Воздушные вяжущие вещества (воздушная известь, гипсовые и магнезиальные вяжущие) Воздушная известь является местным вяжущим веществом. Ее получают обжигом при температуре 1000—1200 °С кальциево-карбонатных пород (известняка, мела и др.).
СaCO3=CaO+CO2 (не гашённая известь)
Воздушная известь может выпускаться в виде кусков белого или серого цвета и называется комовой. В порошкообразное состояние воздушная известь может превращаться гашением. Гашение извести протекает бурно, с выделением тепла и образованием гидроксида кальция по реакции:
СаО + Н2О = Са(ОН)2 + 15,5 ккал.
Если для гашения взять 40—70 % воды от веса извести, то получается тонкий порошок, который называется гидратной известью.
В зависимости от кол-ва Н2О получают:
1. Пушконку – при добавлении небольшого кол-ва
2. Известковое «тесто» - при добавлении 50% на 50% СаО
3. Известковое молоко – С добавлением в избытке.
Гипсовые вяжущие вещества получают в результате обжига природного двухводного гипсового камня. Из гипсовых вяжущих веществ основными являются строительный, формовочный и ангидритовый цемент.
Строительный гипс получают при обжиге двухводного гипсового камня при температуре 120— 170 °С. В результате обжига происходит гидратация и двуводный гипсовый камень переходит в полуводное состояние по реакции: 2(CaSО4*2H2О) = 2(CaSО4*0,5H2О) + 3H2О
Строительный гипс относится к быстротвердеющим вяжущим. Применяют при оштукатуривании помещений и получения сухой гипсовой штукатурки, перегородочных плит.
Ангидритовый цемент медленно схватывается, состоит из гипса и ангидрита. Используется для шлакобетонных сплошных изделий, изготовление бетонных полов, теплоизоляционных материалов.
Магнозальные. Природный магнезит MgCO3 обжигают при t = 750-800
MgCO3=MgO+CO2
Обладает вы
| <== предыдущая страница | | | следующая страница ==> |
| Санитарно–гигиеническая оценка физических свойств воздуха | | | ИНФОРМАЦИОННЫЙ БЮЛЛЕТЕНЬ № 2 о конференциях, состоявшихся на базе филиала Федерального научно методического центра имени Леонида Владимировича Занкова |
Дата добавления: 2014-12-09; просмотров: 650; Нарушение авторских прав

Мы поможем в написании ваших работ!