
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
I.1. СТРОЕНИЕ ФЕРМЕНТОВ
Биологически активные вещества
Методическая разработка
СОДЕРЖАНИЕ
I. Ферменты …………………………………………………….………
I.1. Строение ферментов ……………………...……….……………….
I.2. Механизм действия ферментов ……………………………….….
I.3. Факторы, влияющие на скорость ферментативной реакции …....
I.4. Номенклатура и классификация ферментов……………………..
II. Витамины…………………………………………………………..…..
II.1. Номенклатура и классификация витаминов…………………….
II.2. Общее понятие об гипо-, авитаминозах и гипервитаминозах…
II.3. Характеристика жирорастворимых витаминов…………………
II.4. Характеристика водорастворимых витаминов………………….
II.5. Взаимосвязь витаминов с ферментами ………………………….
III. Гормоны ……………………………………………………………….
III.1. Номенклатура и классификация гормонов…………..…………
III.2. Механизм действия гормонов …………………………….…….
III.3. Биосинтез и секреция гормонов………………………………...
IV.Антибиотики……………………………………………………………
Литература…………………………………………………………………
I. ФЕРМЕНТЫ
Ферменты - это биологические катализаторы белковой природы. Между ферментами и неорганическими катализаторами есть сходства и различия, связанные с белковой природой ферментов.
Сравнительная характеристика свойств ферментов и неорганических катализаторов представлена в таблице 1.
Таблица 1. Сравнение свойств ферментов и неорганических катализаторов.
| Показатель | Неорганические катализаторы | Ферменты |
| Количество вещества | Макроколичества | Микроколичества |
| Химическая природа | Низкомолекулярные вещества, состоящие из одного или нескольких химических элементов | Белки – высокомолеку-лярные соединения, состоящие из тысяч различных атомов |
| Специфичность | Низкая | Высокая |
| Оптимум температуры | Высокий (1000С и выше) | Низкий (35-450С) |
| Оптимум рН | Сильно кислая или сильно щелочная среда | Физиологический диапазон рН среды |
| Оптимальное рабочее давление | Высокое (несколько атмосфер) | Атмосферное (нормальное) |
| Изменение структуры катализатора в ходе реакции | Не изменяется | Изменяется и восстанавливается в исходную структуру по окончании реакции |
| Увеличение скорости | В 102—106 раз | В 108—1011 раз (высоко эффективные вещества) |
Общие свойства ферментов и неорганических катализаторов.
1) Не ускоряют термодинамически невозможных реакций.
2) Не влияют на положение равновесия обратимой реакции, а только ускоряют его достижение, т.е. ускоряют как прямую, так и обратную реакцию.
3) Не влияют на энергетический эффект реакции.
4) Выходят из реакции в неизменном виде.
Отличие ферментов от неорганических катализаторов.
1) Высокая эффективность действия ферментов (высокая скорость реакции и практически 100% выход). Например, разложение перекиси водорода в присутствии фермента каталазы происходит в 107 раза быстрее, чем в присутствии мелко раздробленной платины. Причина повышения скорости реакции ферментами заключается в значительном уменьшении энергии активации. Сравним энергии активации разложения перекиси водорода: самопроизвольно – 75,2 кДж/моль; в присутствии катализатора платины – 50,2 кДж/моль; фермента каталазы – 8,3 кДж/моль. Энергия активации – дополнительная энергия, которой должны обладать молекулы, чтобы стать активными и провзаимодействовать (рис. 1).
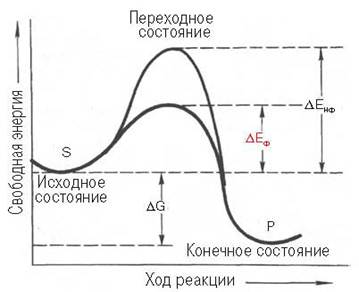
Рис. 1. Зависимость изменения свободной энергии от хода реакции.
2) Высокая специфичность действия ферментов. Специфичность – способность фермента связываться с определенным субстратом или группой субстратов. Различают 3 вида субстратной специфичности:
а) Абсолютная – фермент катализирует превращение строго определенного субстрата. Например, уреаза расщепляет только мочевину, аргиназа – аргинин.
б) Относительная – фермент катализирует превращение нескольких субстратов, имеющих один тип связи. Например, липаза расщепляет сложноэфирную связь между глицерином и любой высшей жирной кислотой в молекуле жира.
в) Стереохимическая – фермент катализирует превращение только одного стереоизомера при наличии их смеси. Например, L-оксидаза превращает L-аминокислоту, но не действует на Д-изомер.
3) Ферменты действуют в «мягких» условиях внутренней среды организма.
4) Высокая чувствительность ферментов к различным физико-химическим факторам среды – температуре, рН, ионной силе раствора и др., что связано с белковой природой ферментов. Кроме того, активность ферментов зависит от возраста, пола и физиологических состояний организма.
5) Активность ферментов регулируется специальными веществами – активаторами или ингибиторами.
I.1. СТРОЕНИЕ ФЕРМЕНТОВ
Высокая эффективность и специфичность действия ферментов объясняется их строением.
По строению различают простые (состоят только из аминокислот) и сложные (кроме аминокислот содержат добавочные группы небелковой природы) ферменты.
Белковая часть фермента называется апофермент, небелковая – кофактор. Природный комплекс, состоящий из апофермента и кофактора называется холофермент. В зависимости от природы связи между белковой и небелковой частью различают 2 типа кофактора: а) простетическая группа – прочно (ковалентно) связанная с апоферментом небелковая часть, примеры – ионы металлов, гем-группа цитохромов; б) кофермент – относительно слабо связанная (водородными или электростатическими взаимодействиями) с апоферментом и легко отделяемая от него при диссоциации небелковая часть, примеры – витамины группы В или их содержащие вещества.
По своим размерам молекула фермента, как правило, превышает размеры молекул субстрата (S) – вещества, на которое действует фермент; активаторов (А) - веществ, ускоряющих активность фермента; ингибиторов (I) - веществ, тормозящих активность фермента. Поэтому в молекуле фермента выделяют несколько участков - центров.
Активный центр фермента (АЦ) – участок молекулы фермента, где происходит связывание субстрата и превращение его в продукт. Он имеет форму узкого углубления или щели, что создает микроокружение, благоприятное для катализа. В простом ферменте АЦ образован: несколькими функциональными группами сближенных в пространстве радикалов аминокислот (например, -NH2 лизина, -COOH аспарагиновой или глутаминовой, -ОН серина, -SH цистеина). В сложном ферменте в АЦ входит ещё кофактор.
В АЦ условно выделяю два участка:
субстратный центр (якорная площадка или центр связывания) - ответственнен за присоединение субстрата и образован радикалами аминокислот;
каталитический центр – обеспечивает катализ, образован радикалами аминокислот в простом ферменте и кофактором в сложном.
Аллостерический центр – участок молекулы фермента, изменяющий активность фермента. Это центр, пространственно удаленный от активного. В этот центр присоединяются низкомолекулярные вещества (активаторы или ингибиторы), что ведет к изменению третичной структуры всего фермента и АЦ в том числе, в результате активность фермента увеличивается или уменьшается.
| <== предыдущая страница | | | следующая страница ==> |
| Тематика курсовых работ | | | I.2. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ |
Дата добавления: 2014-12-09; просмотров: 554; Нарушение авторских прав

Мы поможем в написании ваших работ!