
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
I.3. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ
Факторы, влияющие на скорость ферментативной реакции, влияют также и на активность ферментов. К ним относят:
1) концентрация субстрата и фермента,
2) условия протекания реакции (температура, рН среды, давление),
3) наличие активаторов и ингибиторов.
Рассмотрим их более подробно.
Влияние концентрации субстрата.
В 1913 г. Михаэлис и Ментен показали, что скорость ферментативной реакции не прямо пропорциональна концентрации субстрата. При увеличении концентрации субстрата и постоянной концентрации фермента скорость вначале увеличивается линейно (а – реакция первого порядка), затем переходит в реакцию смешанного порядка (б), затем стремится к максимальной скорости (в – реакция нулевого порядка) (рис. 2).

Рис. 2. Зависимость скорости ферментативной реакции от концентрации субстрата.
Для описания зависимости скорости ферментативной реакции от концентрации субстрата было предложено уравнение Михаэлиса-Ментен:
υmax . [S]
υ = ——— ,
KS + [S]
где υmax – максимальная скорость, [S] – концентрация субстрата, КS – константа диссоциации фермент-субстратного комплекса.
Преобразуя это уравнение, делением на [S], можно получить:
υmax
υ = ———— .
1 + KS /[S]
Следует отметить, что уравнение Михаэлиса-Ментен не учитывает влияние на скорость ферментативного процесса продуктов реакции. Бриггс и Холдейн модифицировали это уравнение, введя константу Михаэлиса Кm. Константа Михаэлиса представляет отношение констант скоростей распада фермент-субстратного комплекса ES к константе скорости его образования: Кm = (k-1 + k+2 ) / k+1
для ферментативной реакции:
k+1 k+2
E + S ↔ ES ↔ E + P .
k-1
В результате Бриггс и Холдейн получили уравнение:
υmax
υ = ———— .
1 + Km /[S]
Если Кm = [S], то по уравнению υ = υmax / (1+1) = υmax /2. Это означает, что Кm численно равна концентрации субстрата, при которой скорость реакции равна половине от максимальной величины.
Кm – это мера сродства данного субстрата к ферменту: если Кm велика, это означает, что потребуется много субстрата для достижения ½. υmax (реакция идет медленно); низкая величина Кm указывает на то, что для насыщения фермента достаточно небольшое количество субстрата. Итак, Кm большая – низкое сродство S к E, Кm малая - высокое сродство S к E.
Таким образом, применяя данные уравнения, можно количественно характеризовать эффективность действия ферментов.
Влияние концентрации фермента.
При условии избытка субстрата скорость ферментативной реакции прямо пропорциональна концентрации фермента. Эта зависимость подчиняется уравнению прямой υ = k. [E].
Влияние рН среды.
Ферменты, как и белки, имеют заряженные группы. Общий заряд молекулы фермента зависит от рН среды. Для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность (рис. 3). Любые отклонения вправо и влево от оптимума рН изменяет заряд фермента, вплоть до достижения изоэлектрической точки (ИЭТ), что приводит к потере каталитических свойств. Большинство ферментов проявляет максимальную активность в узком диапазоне рН. Например, для пепсина оптимум рН 1,5-2,5, для трипсина – 7,8-8,6.
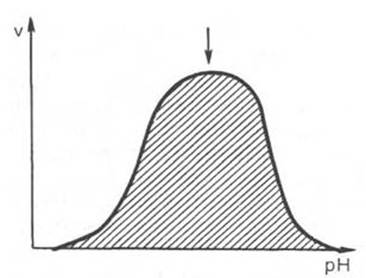
Рис. 3. Зависимость скорости ферментативной реакции от рН среды.
Влияние температуры.
Известно, что скорость химической реакции повышается в 2-4 раза при повышении температуры на каждые 10оС. Однако из-за белковой природы ферментов повышение температуры приведет к тепловой денатурации фермента и снижению скорости реакции. Оптимальная температура – это та температура, при которой скорость реакции максимальна. Для ферментов растений tопт – 45-50 оС, ферментов теплокровных - 37 оС. Исключение миокиназа мышц выдерживает нагревание до 100 оС.
Влияние активаторов на активность ферментов.
Активаторы – вещества, повышающие активность ферментов. Примеры активаторов: чаще катионы - Mg2+, Mn2+, Zn2+, K+, Co2+, Fe2+, Cu2+; реже анионы – Сl-; иногда белки.
Свойства активаторов:
- формируют АЦ фермента (Mg2+, Zn2+, Co2+, Fe2+, Cu2+),
- облегчают образование фермент-субстратного комплекса (Mg2+, Mn2+)
- стабилизируют нативную структуру фермента,
- защищают функциональные группы АЦ фермента от повреждения, например глутатион и цистеин восстанавливают SH-группы активного центра.
Влияние ингибиторов на активность ферментов.
Ингибиторы (I)– вещества, понижающие активность ферментов.
Классификация ингибиторов ферментов. Ингибиторы делят на неспецифические и специфические. Специфические ингибиторы бывают необратимые и обратимые, а среди обратимых выделяют конкурентные (изостерические) и неконкурентные (аллостерические).
Неспецифические ингибиторы (соли тяжелых металлов, кислоты, щелочи) вызывают денатурацию фермента. Их действие не связано с механизмом ферментативного катализа.
Действие специфических ингибиторов связано с механизмом ферментативного катализа.
При необратимом ингибировании образуется прочный комплекс фермента и ингибитора. Даже если удалить ингибитор из среды, та часть молекул фермента, которая успела связаться с ингибитором остается неактивной длительное время, и ингибирование становится необратимым.
Примеры необратимых ингибиторов:
1. Ингибиторы металлосодержащих ферментов – HCN, KCN, CO, NaN3 – влияют на активность ферментов дыхательной цепи, препятствуя переносу электронов на кислород, поэтому их называют дыхательными ядами.
2. Вещества, связываютщие SН-группы активного центра, например моноиодацетат, соединения ртути и мышьяка.
3. Вещества, связываютщие ОН-группы серина в активном центре, например, фосфорорганические соединения – боевые отравляющие вещества.
При обратимом ингибировании образуется непрочный комплекс фермента и ингибитора, способный распадаться, в результате чего фермент вновь становится активным. Обратимые ингибиторы бывают конкурентные и неконкурентные.
Конкурентный ингибитор очень похож на субстрат и фермент не может их различить, т.е. I и S конкурируют за активный центр фермента.
В результате связывания конкурентного ингибитора с активным центром фермента падает концентрация фермент-субстратных комплексов и скорость реакции уменьшается. Однако для активного центра фермента все же лучше подходит субстрат. Поэтому при достаточно большой концентрации субстрата его молекулы начнут вытеснять ингибитор из АЦ фермента, увеличится число молекул фермент-субстратного комплекса и скорость реакции увеличится. Таким образом, путем увеличения концентрации субстрата можно нейтрализовать действие конкурентного ингибитора и достичь максимальной скорости реакции.
Пример конкурентного ингибитора – малонат, который ингибирует фермент сукцинатдегидрогеназу (СДГ), ускоряющую реакцию превращения янтарной кислоты (истинный субстрат) в фумаровую. Малонат похож по строению на сукцинат и может взаимодействовать а АЦ фермента, но фумарат не образуется.
СООН СООН СООН
│ │ │ СДГ реакция
СН2 СДГ СН СН2 → не идет
│ → ║ │
СН2 -2Н СН СООН
│ │ Малоновая кислота
СООН СООН (малонат)
Янтарная кислота Фумаровая кислота
(сукцинат) (фумарат)
Неконкурентные ингибиторы не имеют структурного сходства с субстратом и часто связываются не с АЦ фермента, а с каким-либо другим участком фермента (часто с аллостерическим центром). Поэтому ингибитор может присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу, в обоих случаях инактивируя фермент.
Неконкурентное ингибирование может быть следствием нескольких способов взаимодействия фермента и ингибитора:
1) Блокирование ферментов ионами тяжелых металлов (Hg2+, Pb2+ и др.), которые присоединяются к сульфгидрильным группам полипептидной цепи; солями синильной кислоты, оксидом углерода (II), которые присоединяются к железосодержащим простетическим группам.
2) Присоединение ингибитора к аллостерическому центру, что вызывает такие изменения в структуре фермента, которые передаются в активный центр и нарушают его строение, вызвав инактивацию фермента.
| <== предыдущая страница | | | следующая страница ==> |
| I.2. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ | | | I.4. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ ФЕРМЕНТОВ |
Дата добавления: 2014-12-09; просмотров: 478; Нарушение авторских прав

Мы поможем в написании ваших работ!