
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Получение дезинфицирующего расвора
Используют метод обеззараживания хлоросодержащим раствором, получаемым путем электролиза водного раствора поваренной соли.
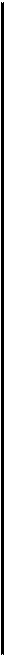 Для этого используют установку ЭДР, содержащую емкость, в которую помещен электролизный аппарат.
Для этого используют установку ЭДР, содержащую емкость, в которую помещен электролизный аппарат.
Перед началом работы в емкость установки заливают 20 л 5 %-ного раствора поваренной соли (1 кг соли на 20 л воды). Затем на электроды электролизного аппарата подают постоянное напряжение 24 В от выпрямителя ВСА-6К (первичное напряжение переменного тока 220 В). Через водный раствор поваренной соли NaCl проходит ток, обусловленный перемещением ионов Na+ и Н+ к катоду, а ионов Сl 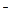 и ОН
и ОН 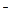 к аноду. На катоде в результате восстановления ионов Н+ выделяется газообразный водород, а на аноде в результате окисления ионов С1
к аноду. На катоде в результате восстановления ионов Н+ выделяется газообразный водород, а на аноде в результате окисления ионов С1 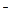 — газообразный хлор. Ионы Na+, соединяясь с ионами ОН-, образуют едкий натр NaOH; хлор, растворяясь в воде, образует хлорноватистую и соляную кислоты:
— газообразный хлор. Ионы Na+, соединяясь с ионами ОН-, образуют едкий натр NaOH; хлор, растворяясь в воде, образует хлорноватистую и соляную кислоты:
С12 + Н2О=НСlO + НС1.
Хлорноватистая кислота взаимодействует с едким натром и образуется гипохлорит натрия NaOCl:
НС10 + NaOH = NaCIO + Н20.
Хлорноватистая кислота и гипохлорит натрия, будучи сильными окислителями, обусловливают дезинфицирующее действие раствора.
Дезинфицирующий раствор готовят 1,5...2 ч. На получение 1 кг активного хлора расходуется 8...10 кг поваренной соли и 5,5...7 кВт-ч электроэнергии. Мощность, потребляемая установкой, составляет 350...600 Вт (по постоянному току).
По сравнению с использованием готовых реагентов (жидкого хлора, хлорной извести, гипохлорита кальция) обеззараживание при помощи электролитического гипохлорита натрия, получаемого на месте, позволяет избежать трудностей и затрат, связанных с транспортировкой и хранением токсических веществ.
Электрокоагуляция. Разделение коллоидного раствора на коагулянт (осадок) и дисперсную среду в электрическом поле или при изменении диэлектрической проницаемости окружающей среды.
Коагуляцию осуществляют путем добавления в неоднородную среду веществ разрушающих сольватированные оболочки и уменьшающие диффузионную часть двойного электрического слоя у поверхности взвешенных частиц В результате между частицами возникают силы сцепления приводящие к образованию агрегатов частиц с большой массой В качестве коагулянтов применяют электролиты (растворимые в воде соли )
Процессы электролиза количественно описывают законом Фарадея
Если анод растворим, то его частицы поступают в раствор с положительным знаком (катионы) и перемещаются к катоду, где нейтрализуются и осаждаются - происходит перенос вещества с анода на катод (процесс гальваностегии и гальванопластики). Электролиз можно использовать для получения таких веществ, как А1(ОН)3 и Fe(OH)3, способствующих коагуляци дисперсных веществ.
Растворение электрода или осаждение на нем ионов зависит от его потенциала. Электрод, помещенный в раствор с ионами его вещества, при некотором равновесном электродном потенциале (РЭП) не растворяется и ионы на нем не осаждаются.
Если на электрод подать отрицательный потенциал по сравнению с равновесным электродным, то начнется выделение вещества, если положительный - растворение электрода. Значение РЭП для различных металлов находится в пределах от - 2,42 В (калий) до + 0,8 В (серебро). За нулевой РЭП принят потенциал водородного электрода. Разность между действительным потенциалом и РЭП называют перенапряжением.
Перенапряжение 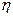 п ,В, и плотность тока jА/м2, связаны уравнением Тафеля
п ,В, и плотность тока jА/м2, связаны уравнением Тафеля
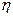 п= a +blgj
п= a +blgj
где а и b — константы.
Константы скорости реакции на аноде и катоде, см/с, зависят от потенциала электрода:
| (7) |
kа = k 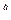
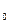 exp[-
exp[- 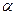 aF(
aF( 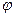 -
- 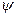 i)/RT];
i)/RT];
kK = k 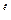
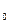 exp[-
exp[- 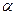 кF(
кF( 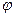 -
- 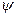 i)/RT];
i)/RT];
где k 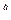
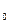 , k
, k 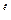
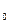 — константы скорости анодной и катодной реакции, см/с;
— константы скорости анодной и катодной реакции, см/с; 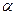 a ,
a , 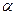 к -коэффи-циенты переноса заряда анодной и катодной реакций; F = 96485 Кл/моль - число Фарадея;
к -коэффи-циенты переноса заряда анодной и катодной реакций; F = 96485 Кл/моль - число Фарадея; 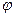 -
- 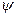 i _ "скачок" потенциала в плотной части двойного слоя, В; R — универсальная газовая постоянная, Дж/(К • моль); T— температура среды, К.
i _ "скачок" потенциала в плотной части двойного слоя, В; R — универсальная газовая постоянная, Дж/(К • моль); T— температура среды, К.
Биологические эффекты действия электрического тока проявляются в стимуляции или угнетении биологических объектов. Они возникают в результате комплексного термического и физико-химического действия
| <== предыдущая страница | | | следующая страница ==> |
| Рассоление почв электроосмосом | | | Электромембранные процессы. Основная область применения электродиализа - опреснение воды |
Дата добавления: 2014-12-09; просмотров: 136; Нарушение авторских прав

Мы поможем в написании ваших работ!