
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лабораторная работа № 3. «Скорость химических реакций»
«Скорость химических реакций»
Цель работы
Определить зависимость скорости химической реакции в жидкой фазе от концентрации реагирующих веществ.
Теоретическая часть
Скорость гомогенной химической реакции это изменение концентрации исходных веществ или продуктов реакции за единицу времени.
 моль/л∙мин
моль/л∙мин
К важнейшим факторам, влияющим на скорость, относятся: концентрация, температура и наличие катализатора.
Влияние концентрации веществ на скорость реакции описывается законом действующих масс (кинетическим уравнением).
В общем виде для простой (элементарной) реакции
 аА+bB продукты реакции
аА+bB продукты реакции
уравнение имеет вид: 
где k – константа скорости реакции, не зависящая от концентраций, но завися- щая от природы веществ, температуры и катализатора.
В данной работе изучается скорость реакции между раствором тиосульфата натрия и раствором серной кислоты.
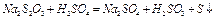
Данная реакция сопровождается выпадением в осадок элементарной серы, т.е. помутнением раствора. Время, которое проходит от момента сливания растворов до «начала помутнения» характеризует скорость данной реакции.
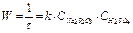
В наших опытах концентрацию серной кислоты будем поддерживать постоянной, а концентрацию соли изменять, разбавляя исходный раствор водой. Выражение для скорости реакции упрощается:
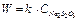
Математически скорость при изменении концентрации соли должна изменяться прямопропорционально по линейному уравнению типа  .
.
Экспериментальная часть
Опыт 1.
Ход работы:
1. В коническую колбу с помощью мерного цилиндра налить 12 мл раствора 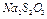 исходной концентрации.
исходной концентрации.
2. В отдельном мерном цилиндре приготовить 4 мл раствора 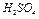 .
.
3. Быстро влить кислоту в колбу и включить секундомер.
4. Внимательно следить за реакцией, при появлении легкого помутнения выключить секундомер, записать время реакции (например, 20 сек.).
| <== предыдущая страница | | | следующая страница ==> |
| Лабораторная работа № 2. Определить направление смещения химического равновесия для реакций, протекающих в жидкой и газообразной фазе | | | Опыт 3 |
Дата добавления: 2015-06-30; просмотров: 170; Нарушение авторских прав

Мы поможем в написании ваших работ!