
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Определение галогенидов
Галогениды методом Фольгарда анализируют обратным титрованием. Навеску или аликвоту галогенида, например, NaCl, обрабатывают в кислой среде точно отмеренным избытком стандартного раствора AgNO3. Ионы Cl- осаждаются в виде AgCl, а остаток AgNO3 титруют стандартным раствором NH4SCN в присутствии железоаммонийных квасцов.
NaCl + AgNO3 = AgCl ¯ + NaNO3 + [AgNO3]
AgNO3 + NH4SCN = AgSCN ¯ + NH4NO3
| |||||||
| |||||||
| |||||||
|
3NH4SCN + NH4Fe(SO4)2 = [Fe(SCN)3] + 2(NH4)2SO4
ПР AgCl = 1,78×10-10
ПР AgSCN = 1,1×10-12
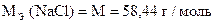
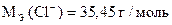
Титровать избыток AgNO3 можно, отделив осадок AgCl или без отделения осадка AgCl.
При титровании без отделения осадка AgCl возможно взаимодействие осадка AgCl с [Fe(SCN)3] при сильном перемешивании раствора. При этом появившаяся красная окраска может исчезнуть. Это можно объяснить различным ПР AgCl и ПР AgSCN.
Ионы Ag+ в насыщенном растворе AgCl могут взаимодействовать с ионами SCN- из насыщенного раствора [Fe(SCN)3], образуя менее растворимый осадок AgSCN.
Ag+ + SCN- = AgSCN ¯
|
Для предупреждения взаимодействия [Fe(SCN)3] с AgCl раствор после появления розовой окраски не следует энергично перемешивать. Окраска должна удерживаться » 30 сек.
| <== предыдущая страница | | | следующая страница ==> |
| Определение Ag в серебряном сплаве | | | Опорный конспект по методам осаждения |
Дата добавления: 2015-07-26; просмотров: 183; Нарушение авторских прав

Мы поможем в написании ваших работ!