
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Фазовая Р-Т диаграмма состояний
Для простоты рассмотрим Р-Т диаграмму однокомпонентной термодеформационной системы, у которой фазами являются агрегатные состояния: твердое, жидкое и газообразное, и в твердой фазе нет дополнительных кристаллических модификаций.
Сплошные линии 1, 2, 2', 3 на рис. 3.1 и 3.2 соответствуют двухфазным состояниям вещества (Р = 2, n = 1) и называются кривыми равновесия фаз. Все кривые равновесия рассматриваемой системы сходятся в одной точке Т, называемой тройной точкой (более подробно о тройных точках будет сказано в параграфе 3.3).


Рис.3.1. Р-Т диаграмма Рис.3.2. Р-Т диаграмма
нормального вещества аномального вещества
Обозначения:
Тв – твердая фаза;
г – газообразная фаза;
п – пар (частный случай газообразной фазы);
ж – жидкая фаза.
Нормальными веществами принято называть такие вещества, у которых удельный объем жидкой фазы больше, чем объем твердой фазы, т.е.

Аномальными веществами называют вещества, у которых

Простой способ определения принадлежности веществ к нормальным или аномальным заключается в следующем: если твердое вещество плавает в своем расплаве  , то оно относится к аномальным веществам, если тонет в своем расплаве
, то оно относится к аномальным веществам, если тонет в своем расплаве  – к нормальным.
– к нормальным.
Здесь:  – плотность жидкой и твердой фаз соответственно.
– плотность жидкой и твердой фаз соответственно.
Линия ТК – это кривая, каждая точка на которой, соответствует равновесному сосуществованию жидкой и газообразной (паровой) фаз.
Линия Т2 – равновесному сосуществованию жидкой и твердой фаз нормального вещества.
Линия Т2' – равновесному сосуществованию жидкой и твердой фаз аномального вещества.
Линия Т3 – равновесному сосуществованию твердой и газообразной фаз.
Между этими кривыми равновесия двух фаз находятся области однофазных состояний, где Р и Т могут изменяться независимо друг от друга, не нарушая данного фазного состояния.
Все эти кривые равновесия фаз подчиняются уравнению Клапейрона – Клаузиуса (2.1), у которого левая часть  – это угловой коэффициент соответствующей кривой фазового равновесия. Исследуем поведение кривых равновесия фаз с помощью этого уравнения.
– это угловой коэффициент соответствующей кривой фазового равновесия. Исследуем поведение кривых равновесия фаз с помощью этого уравнения.
Кривая ТК называется кривой парообразования или кривой насыщения. При парообразовании теплота к системе подводится, т.е. λисп >0. Т.к. и всегда Т > 0, то
и всегда Т > 0, то  , то есть кривая равновесия жидкой и газообразной (паровой) фаз идет вверх слева направо. Кривая парообразования заканчивается в точке К, которой соответствует единственное для данного вещества сочетание давления и температуры (Рк и Тк). Эта точка называется критической. При Т>Тк жидкость и газ не могут сосуществовать в виде равновесной двухфазной системы.
, то есть кривая равновесия жидкой и газообразной (паровой) фаз идет вверх слева направо. Кривая парообразования заканчивается в точке К, которой соответствует единственное для данного вещества сочетание давления и температуры (Рк и Тк). Эта точка называется критической. При Т>Тк жидкость и газ не могут сосуществовать в виде равновесной двухфазной системы.
Область жидкой фазы на Р-Т диаграмме располагается между кривой парообразования ТК, кривой равновесия жидкой и твердой фаз Т2 (или Т2' для аномальных веществ) и ограничивается справа критической изотермой Тк (штрих-пунктирная прямая на рис. 3.1 и 3.2). Более подробно критическая точка рассматривается в параграфе 3.3
Кривая Т2 называется кривой плавления для нормальных веществ.При плавлении теплота к системе подводится  ,
,  , Т>0, следовательно
, Т>0, следовательно  и кривая равновесия жидкой и твердой фаз для нормальных веществ идет вверх слева направо. Т.к.
и кривая равновесия жидкой и твердой фаз для нормальных веществ идет вверх слева направо. Т.к.  , то кривая плавления Т2 идет круче, чем кривая парообразования ТК.
, то кривая плавления Т2 идет круче, чем кривая парообразования ТК.
Кривая Т2' называется кривой плавления для аномальных веществ. В отличие от кривой Т2 кривая Т2' идет вверх справа налево, т.к. у аномальных веществ  и, следовательно,
и, следовательно,  .
.
Вода – аномальное вещество и линия плавления воды в Р -Т диаграмме имеет угловой коэффициент меньше нуля.
То, что у воды при плавлении  , объясняет опыт, в котором тонкая проволока с грузом на концах, будучи положенной на обычный лед (кристаллическая модификация III1), проходит через него при низких температурах без нагревания проволоки.
, объясняет опыт, в котором тонкая проволока с грузом на концах, будучи положенной на обычный лед (кристаллическая модификация III1), проходит через него при низких температурах без нагревания проволоки.
К аномальным веществам, которые по определению увеличивают свой объем при плавлении, относятся вода (лед), висмут, гелий, германий, плутоний, галлий, гадолиний, кремний и некоторые сплавы (например, сурьма). Например, плотность льда при нормальном давлении и температуре 00С равна 0,917 кг/м3, т.е. меньше воды жидкой.
Теплота плавления по абсолютному значению равна теплоте кристаллизации. Зависимость температуры плавления от давления определяется уравнением Клапейрона – Клаузиуса.
Для нормальных веществ температура плавления с ростом давления повышается, а для аномальных веществ – понижается. Этим объясняется, в частности, подвижность ледников, у которых нижние слои льда, находящиеся под большим давлением, начинают таять. Хорошее скольжение при катании на коньках также объясняется тем, что под полозьями коньков создается большое давление на лед и температура его плавления понижается настолько, что он начинает таять.
Аморфные тела (стекло, воск, канифоль, смола) обладают изотропными свойствами и поэтому не имеют определенной температуры плавления. При подводе теплоты они не плавятся, а размягчаются, сохраняя однородное состояние. Постепенно эти тела превращаются в густую жидкость, вязкость которой уменьшается по мере роста температуры. Аморфное состояние можно рассматривать как переохлажденную жидкость с очень высоким коэффициентом вязкости.
Жидкая фаза является конденсированным состоянием вещества, промежуточным между твердым и газообразным. При этом жидкость сохраняет отдельные свойства твердой фазы (определение объема, наличие поверхностей раздела, прочность на разрыв) и некоторые свойства газа (изменчивость формы по форме сосуда, сжимаемость). Особыми свойствами жидкой фазы являются текучесть и упругость.
Большинство веществ имеет только одну жидкую фазу. Исключением являются так называемые жидкие кристаллы, у которых кроме нормальной изотропной жидкой фазы, существуют еще и анизотропные. Это относится к жидкостям, молекулы которых имеют вытянутую линейную форму и в некотором интервале температур обладают анизотропными свойствами. Жидкий гелий (так называемая квантовая жидкость) также может находиться в двух разных жидких фазах: Не I и Не II (сверхтекущее состояние).
Кривая ТЗ называется кривой сублимации (возгонки)
При сублимации теплота к системе подводится  ,
,  , Т>0, поэтому
, Т>0, поэтому  .
.
Таким образом, кривая сублимации идет от тройной точки Т вниз справа налево. Кривая сублимации имеет больший угловой коэффициент, нежели кривая парообразования, т.е. Т3 идет круче, чем ТК, т.к.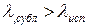 ( как известно,
( как известно,  ).
).
Кривая сублимации Т3 в координатах Р – Т проходит через начало координат, т.к. при  давление пара над кристаллами стремится к нулю. При абсолютном нуле все вещества независимо от величины давления должны находится в кристаллическом состоянии (исключение составляет лишь гелий II).
давление пара над кристаллами стремится к нулю. При абсолютном нуле все вещества независимо от величины давления должны находится в кристаллическом состоянии (исключение составляет лишь гелий II).
| <== предыдущая страница | | | следующая страница ==> |
| Уравнение Клапейрона – Клаузиуса | | | Фазовые P – V и T – S диаграммы состояний |
Дата добавления: 2015-07-26; просмотров: 203; Нарушение авторских прав

Мы поможем в написании ваших работ!