
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Способы индикации конца титрования в аргентометрии
| Метод | Индикатор | Принцип действия индикатора | Определяемые ионы |
| Гей-Люссака | Безиндикаторный | Титрование до просветления, т.е. когда новая порция титранта не вызывает помутнения раствора | Br - |
| Мора | K2CrO4 | Появление в щелочной среде кирпичного цвета осадка Ag2CrO4 при избытке титранта | Cl - , Br - |
| Фольгарта | FeCl3 | Появление красного окрашивания при избытке раствора NH4CNS в качестве титранта | Ag+ (прямое титрование); Cl-, CN-, CrO42-, CO32-, PO43 - (обратное титрование) |
| Фаянса | Адсорбционные индикаторы (эозин, флюоресцин) | Адсорбция индикатора на осадке при избытке титранта и изменении окраски осадка | Br-, Cl-, I-, SeO32 - |
Точка эквивалентности в методах осаждения может быть определена титрованием без индикатора и с индикатором. Индикаторы делятся на
1. осадительные;
2. адсорбционные;
3. металлохромные.
1 - осадительные индикаторы (хроматат калия, железоаммонийные квасцы) - Сущность их действия: вступают в реакцию с рабочим раствором с образованием осадков или окрашенных растворов, окраска которых отличается от окраски основного осадка или раствора. Осадок должен иметь большую растворимость, чем основной осадок.
2. адсорбционные индикаторы (флюоресцеин, эозин) – В точке эквивалентности индикатор адсорбируется на поверхности осадка, придавая ему соответствующую окраску. Индикаторы применяются в тех случаях, когда образующиеся осадки сами не окрашены.
3. металлохромные индикаторы дают с титрантом цветной комплекс, образующийся около точки эквивалентности. Устойчивость этого комплекса должна быть меньше, чем устойчивость осадка, получающегося при осадительном титровании, иначе комплекс с индикатором будет образовываться раньше осадка.
В зависимости от рабочего раствора:
- аргентометрия (способ Мора) – рабочий раствор нитрата серебра;
- меркурометрия – раствор нитрата ртути (I);
- меркуриметрия – раствор нитрата ртути (II);
- роданометрия (способ Фольгарда) рабочий раствор роданида аммония
По способу аргентометрии (способ Мора) определяемый компонент титруют рабочим раствором нитрата серебра в присутствии индикатора – хромата калия. Конец титрования обнаруживают по образованию кирпично-бурого осадка хромата серебра, который появляется после полного осаждения определяемых хлорид-ионов. Хромат калия с нитратом серебра образует кирпично-красный осадок хромата серебра, более растворимый, чем осадок хлорида серебра:
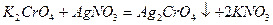
Титрование проводят в нейтральном растворе, так как Аg2СrО4 растворим в кислотах. После выпадения белого осадка АgС1 в момент эквивалентности:
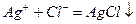
избыточная капля титранта АgNО3 образует с ионами СrО42- осадок Аg2СrО4, который и окрашивает содержимое колбы в кирпично-красный цвет.
Этот метод неприменим в кислых растворах и сильно щелочных растворах. В кислотах хромат калия переходит в дихромат калия, который образует с ионами серебра красный осадок, растворимый в кислотах.
В сильнощелочном растворе образуется оксид серебра. Поэтому рН раствора должен быть не меньше 6,5 и не больше 10. Если раствор кислый, то его предварительно нейтрализуют раствором буры или раствором бикарбоната натрия, или оксидом магния.
Применяется для определения хлоридов, бромидов, среда – нейтральная или слабощелочная при комнатной температуре. Иодиды и тиоцианаты этим методом не определяют, так как осадки АgI и АgSCN способны адсорбировать индикатор – хромат калия. И поэтому они окрашиваются до точки эквивалентности и имеют нечеткую окраску.
По способу роднанометрии (способ Фольгарда) к исследуемому раствору, содержащему хлорид-ионы, прибавляют избыток титрованного раствора нитрата серебра, а затем остаток его оттитровывают раствором роданида аммония в присутствии индикатора – реагента железоаммонийных квасцов NH4[Fe(SO4)2]×12H2O. Титрование возможно в кислой среде.
Меркурометрическое титрование,титрант – раствор Нg2(NО3)2.
Этот метод основан на реакции осаждения раствором Нg2(NО3)2 различных анионов:
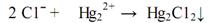
Меркурометрический метод титрования имеет ряд преимуществ по сравнению с аргентометрическим методом: может применяться для титрования в кислой среде; соли ртути менее дефицитны; меньшее число ионов оказывает влияние на точность определения. Главный недостаток заключается в том, что соли ртути ядовиты. Поэтому при применении меркурометрического титрования необходимо соблюдать особую осторожность и аккуратность.
Способ Фаянса(титрование с адсорбционным индикатором) - основан на избирательной адсорбции осадками ионов из раствора. В случае титровании хлорид ионов нитратом серебра в присутствии флюоресцеина в начале титрования в растворе наблюдается избыток хлорид ионы, которые адсорбируясь на образующемся осадке хлорида серебра зарядят его отрицательно. В точке эквивалентности катионы серебра и хлорид-ионы адсорбируются с равной силой, в результате коллоидные частицы хлорида серебра становятся нейтральными и способны коагулировать. Раствор становиться прозрачным. При избытке нитрата серебра осадок адсорбирует катионы серебра и заряжается положительно. Следовательно, вблизи эквивалентной точки происходит перемена знака заряда поверхности осадка отрицательного на положительный. Флюоресцирин - органический краситель кислотного характера, анион которого сильно окрашен, поэтому происходит адсорбция аниона на осадке хлорида серебра. Вследствие этого садок меняет свою окраску, что указывает на конец реакции. Титрование применяют при определении хлоридов в различных природных и технических продуктах.
| <== предыдущая страница | | | следующая страница ==> |
| Методы осаждения | | | Приготовление растворов - титрантов |
Дата добавления: 2015-07-26; просмотров: 403; Нарушение авторских прав

Мы поможем в написании ваших работ!