
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Поверхностные дефекты
Поверхностные дефекты имеют малую толщину и значительные размеры в двух других измерениях. Обычно это места стыка двух ориентированных участков кристаллической решетки. Ими могут быть границы зерен, границы фрагментов внутри зерна, границы блоков внутри фрагментов. Соседние зерна по своему кристаллическому строению имеют неодинаковую пространственную ориентировку решеток. Блоки повернуты друг по отношению к другу на угол от нескольких секунд до нескольких минут, их размер 10–5 см. Фрагменты имеют угол разориентировки не более 5°. Если угловая разориентировка решеток соседних зерен меньше 5°, то такие границы называются малоугловыми границами. Такая граница показана на рис. 1.11. Все субзеренные границы (границы фрагментов и блоков) — малоугловые. Строение границ зерен оказывает большое влияние на свойства металла.
Граница между зернами представляет собой узкую переходную зону шириной 5–10 атомных расстояний с нарушенным порядком расположения атомов. В граничной зоне кристаллическая решетка одного зерна переходит в решетку другого (рис. 1.13). Неупорядоченное строение переходного слоя усугубляется скоплением в этой зоне дислокаций и повышенной концентрацией примесей.
Плоскости и направления скольжения в соседних зернах не совпадают. Скольжение первоначально развивается в наиболее благоприятно ориентированных зернах. Разная ориентировка систем скольжения не позволяет дислокациям переходить в соседние зерна, и, достигнув границы зерен, они останавливаются. Напряжения от скопления дислокаций у границ одних зерен упруго распространяются через границы в соседние зерна, что приводит в действие источники образования новых дислокаций (источники Франка—Рида). Происходит передача деформации от одних зерен к другим, подобно передаче эстафеты в легкоатлетических соревнованиях.
Вследствие того, что границы зерен препятствуют перемещению дислокаций и являются местом повышенной концентрации примесей, они оказывают существенное влияние на механические свойства металла.
Под размером зерна принято понимать величину его среднего диаметра, выявляемого в поперечном сечении. Это определение условно, так как действительная форма зерна в металлах меняется в широких пределах — от нескольких микрометров до миллиметров. Размер зерна оценивается в баллах по специальной стандартизованной шкале и характеризуется числом зерен, приходящихся на 1 мм2 поверхности шлифа при увеличении в 100 раз (рис. 1.14).
Процесс пластического течения, а, следовательно, и предел текучести зависят от длины свободного пробега дислокаций до «непрозрачного» барьера, т. е. до границ зерен металла. Предел текучести sТ связан с размером зерна d уравнением Холла—Петча: sТ = sо + kd–1/2, где sо и k — постоянные для данного металла. Чем мельче зерно, тем выше предел текучести и прочность металла. Одновременно при измельчении зерна увеличиваются пластичность и вязкость металла. Последнее особенно важно для металлических изделий, работающих при низких температурах. Повышенные пластичность и вязкость обусловлены более однородным составом и строением мелкозернистого металла, отсутствием в нем крупных скоплений, структурных несовершенств, способствующих образованию трещин.
Рост зерен аустенита эффективно затрудняет дисперсные частицы второй фазы — карбидов, нитридов, неметаллических включений. Частицы нитрида AlN, содержащиеся в спокойных сталях, раскисленных алюминием, препятствуют росту аустенитных зерен.
В легированных сталях рост зерен аустенита тормозится карбидами и карбонитридами легирующих элементов V, Ti, Nb, микродобавки которых в количестве около 0,1 % специально вводят в стали с целью сохранения мелкого зерна аустенита вплоть до 1000 °С. Использование этих элементов одновременно обеспечивает мелкозернистую структуру и снижение критической температуры хрупкости.
Помимо перечисленных дефектов в металле имеются макродефекты объемного характера: поры, газовые пузыри, неметаллические включения, микротрещины и т. д. Эти дефекты снижают прочность металла.
3. Понятие о диаграммах фазового равновесия систем. Цель их существования.
фазовая диаграмма иначе диаграмма состояния (англ. phase diagram) — графическое изображение состояний термодинамической системы в пространстве основных параметров состояния — температуры T, давления p и состава x.
Фазовые диаграммы позволяют узнать, какие фазы (т. е. однородные подсистемы, отличающиеся строением и/или свойствами от других) могут присутствовать в данной системе при данных условиях и составе. Для сложных систем, состоящих из многих фаз и компонентов, построение диаграмм состояния по экспериментальным данным и данным термодинамического моделирования является важнейшим способом предсказания поведения в ходе различных процессов. Анализ относительного расположения полей, разделяющих их поверхностей и линий, а также точек сочленения последних позволяет однозначно и наглядно определять условия фазовых равновесий, появления в системе новых фаз и химических соединений, образования и распада жидких и твердых растворов и т. п.
Диаграммы состояния используют в материаловедении, металлургии, нефтепереработке, химической технологии (в частности, при разработке методов разделения веществ), производствах электронной техники и микроэлектроники и др. С их помощью подбирают условия промышленного синтеза веществ, определяют направленность процессов, связанных с фазовыми переходами, осуществляют выбор режимов термообработки, отыскивают оптимальные составы фаз и т. п.
Фазовые диаграммы однокомпонентных систем изображаются на плоскости в координатах p–T. На них присутствуют поля, отвечающие существованию той или иной фазы вещества (газообразной, жидкой, различных твердых модификаций), разделенные линиями фазового равновесия, вдоль которых возможно сосуществование граничащих фаз. Места, где сходятся три различные линии фазовых равновесий, образуют так называемые тройные точки, в которых могут сосуществовать три фазы. Это максимальное число фаз, способных равновесно сосуществовать в однокомпонентных системах.
Число фаз, присутствующих в данной точке фазовой диаграммы, определяется правилом фаз Гиббса и составляет n + 2 – f, где n — число компонентов, т. е. тех веществ, количество которых в системе может изменяться независимо от остальных, число 2 отвечает давлению и температуре (таким образом, n + 2 есть число параметров, задающих состояние системы, а f — число степеней свободы, т. е. число тех обобщенных сил (давление, температура, химические потенциалы компонентов), которые можно независимо варьировать в некоторых пределах, не меняя при этом равновесного фазового состава.
Например, внутри полей однокомпонентной фазовой диаграммы, где присутствует единственная фаза, можно независимо варьировать давление и температуру, а тройная точка является так называемой точкой нонвариантного равновесия.
Кроме того, на фазовой диаграмме однокомпонентной системы могут изображаться метастабильные фазы, т. е. фазы, не являющиеся равновесными, но способные существовать в определенной области параметров в течение длительного времени вследствие кинетической стабильности, а также критическая точка — точка на линии равновесия жидкость–газ, после которой исчезает скачкообразное различие свойств этих фаз, и понятие фазового перехода теряет смысл.
Помимо температуры и давления могут рассматриваться и другие параметры состояния системы, например, напряженность магнитного поля (H). Тогда фазовая диаграмма становится многомерной и рассматриваются различные ее сечения, например H–T, а в правиле фаз число 2 меняется на соответствующее число обобщенных сил (полей).
Фазовые диаграммы многокомпонентных систем также являются многомерными. Удобно изучать их плоские сечения, такие, как температура-состав и давлениесостав. Для изобарно-изотермических сечений фазовых диаграмм трехкомпонентных систем, описывающих зависимость фазового состава системы только от ее компонентного состава, используют так называемые треугольники Гиббса.
Обсужденные выше общие положения применимы и к многокомпонентным фазовым диаграммам. Пример широко используемых в материаловедении изобарных (T–x) сечений двухкомпонентной фазовой диаграммы представлен на рис. Поля таких диаграмм могут отвечать одной или двум сосуществующим фазам, включающим расплав компонентов, твердые фазы чистых компонентов или их соединений промежуточного состава, фазы твердых растворов.
Соотношение фаз в поле, отвечающем двум фазам, определяют по правилу рычага — оно обратно пропорционально соотношению расстояний по горизонтали до ограничивающих поле линий фазовых равновесий, а координаты пересечения горизонтали с этими линиями определяют компонентный состав сосуществующих фаз.
Среди важных элементов T–x сечений двухкомпонентных диаграмм следует упомянуть линию ликвидуса, выше которой наличествует только жидкая фаза; линию солидуса, ниже которой присутствует только твердая фаза, эвтектические точки (точки конгруэнтного плавления), общие для солидуса и ликвидуса (на изломе последнего), и перитектические точки (точки инконгруэнтного плавления, т. е. плавления с частичным разложением твердой фазы) на кривой ликвидуса, в которых могут сосуществовать жидкая фаза и две твердых фазы, а также соответствующие горизонтальные линии эвтектических и перитектических превращений.
Для фаз, состоящих из наноразмерных частиц, может существовать зависимость физических свойств от размера, поэтому фазовую диаграмму иногда заполняют шкалой дисперсности.
4. Основные виды диаграмм.
· столбиковые диаграммы;
· полосовые диаграммы;
· круговые диаграммы;
· линейные диаграммы;
· фигурные диаграммы;
5. Диаграммы Au-Ag, Ag-Cu, Au-Cu, Cu-Sn.
Диаграмма состояния системы, обобщающая результаты исследований, выполненных до середины 50-х годов приведена на рис. Ag и Аu образуют между собой непрерывный ряд твердых растворов. Построенные экспериментально кривые ликвидуса и солидуса хорошо согласуются с расчетными кривыми, полученными термодинамическим путем. Интервал кристаллизации сплавов в средней части диаграммы состояния не превышает примерно 2 °С. Сплав, содержащий 50 % (ат.) Аu, имеет температуры ликвидуса и солидуса, равные, соответственно, 1032,5 и 1030,8 °С . Обнаружено отсутствие непрерывности на кривых зависимости электросопротивления, эффекта Холла и периода кристаллической решетки от состава для сплавов, отвечающих составам Ag3Au, Ag3Au2 и AgAu3. 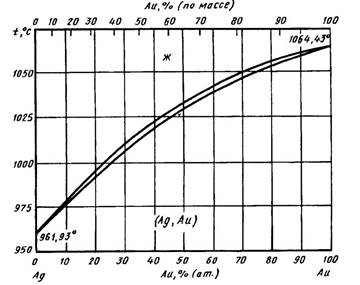
Диаграмма состояния Ag— Cu относится к системам эвтектического типа с ограниченной растворимостью компонентов друг в друге. Для эвтектической температуры даны значения 778—779 °С, а для эвтектической концентрации — значения 39,8; 39,9; 40,4; 40,9 % (ат.) Cu. Температура эвтектического равновесия Ж (Ag) + (Сu) составляет 781 °С. Эвтектика содержит 39,8 % (ат.) Сu. Максимальная растворимость Сu в (Ag) равна 13,6 % (ат.), а максимальная растворимость Agв (Сu) — 4,9 % (ат.) 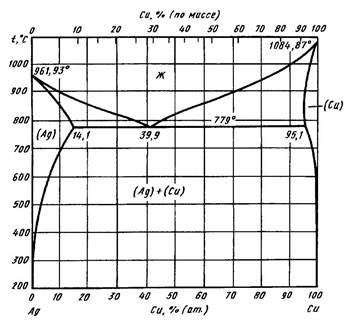
На рис. представлен обобщенный вариант диаграммы состояния Cu-Au. Установлено, что компоненты неограниченно растворимы в жидком состоянии. Кривые ликвидус и солидус имеют касание и проходят через минимум при температуре 905 °С и содержании -59,5 % (ат.) Au. Параметры решетки твердых растворов уменьшаются от Au к Cu с небольшим положительным отклонением от правила аддитивности. При понижении температуры в процессе упорядочения ГЦК твердых растворов в системе образуются три промежуточные фазы — соединения Курна-кова: Au3Cu, AuCu и AuCu3. Температура перитектоидного равновесия образования фазы Au3Cu равна 240 °С, Температура конгруэнтного перехода (Au, Cu) ↔AuCuII составляет 410 °С, а перехода AuCuII ↔AuCuI — 385 °С. Температура эвтектоидного равновесия (Au,Cu) ↔AuCuII + АuСuI равна 285 °С, а конгруэнтного перехода (Au,Cu) ↔ АиСи31 390 °С.
Более высокие значения температур образования соединений AuCu3, AuCu и Au3Cu результат расчета с использованием тстраэдрического приближения метода кластерных вариаций и потенциала Lennard—Jones; точка Курнакова для фазы AuCua составляет 742 °С, для фазы AuCu 536 "С, для фазы Au3Cu 414°С . Соединение AuCu существует в двух модификациях: AuCuI имеет упорядоченную тетрагональную структуру, AuCuII — ромбическую структуру.

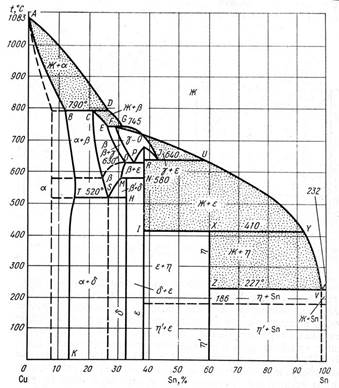
По исследованию диаграммы Cu—Sn имеется большое количество работ,
Ликвидус системы Cu—Sn, определенный методом термического анализа, состоит из шести ветвей первичной кристаллизации фаз α, β, γ, ε, η и Sn. Помимо указанных фаз в системе найдены еще две фазы ζ и δ, которые образуются вследствие превращений, имеющих место в твердом состоянии.
6. 10 основных вопросов, решаемых с помощью диаграмм состояния.
Диаграммы состояния используют в материаловедении, металлургии, нефтепереработке, химической технологии (в частности, при разработке методов разделения веществ), производствах электронной техники и микроэлектроники и т. п. С ее помощью определяют направленность процессов, связанных с фазовыми переходами, осуществляют выбор режимов термообработки, отыскивают оптимальные составы сплавов и т. п.
7. виды взаимодействия элементов в твердом состоянии
8. Теория кристаллизации, структура литого металла.
Структура литого слитка:
При кристаллизации жидкого металла макс степень переохлаждения - при контакте со стенками изложницы. По мере понижения температуры отвод тепла наблюдается нормально поверхности стен.
1 – зона микрозернистых кристаллов
2- зона столбчатых кристаллов
Отвод тепла затруднен во все стороны, то образуется зона крупных равноосных зерен
В процессе кристаллизации имеет место усадка металла. Процесс кристаллизации слитка должен быть таким, чтобы кристаллизация в последнюю очередь заканчивалась в верхней части слитка и усадочная раковина оказалась в верхней части, которая затем удаляется (отрезается) и идет на переплавку.
При переходе метала из жидкого состояния в кристаллическое образуются кристаллы. Процесс этот называется кристаллизацией. Металл стремиться перейти в термодинамически более устойчивое состояние с меньшей свободной энергией.
В процессе кристаллизации закладываются основные особенности поликристаллического состояния металла. В процессе кристаллизации формируется реальная структура, характеризующаяся низкими экскурсионными свойствами металла, которые потом исправляются обработкой давлением или термической обработкой, а так же их сочетанием. Состояние любого вещества определяется температурой и давлением. При постоянном давлении, если детали находятся на земной поверхности, где единственным изменением параметром вещества будет температура, которая влияет на состояние вещества не непосредственно, а через термодинамические характеристики. F- основанная характеристика состояния вещества, называемая энергией Гиббса, которая представляет собой ту часть ионной энергии вещества, которая может изменяться в различных процессах и может превращаться в работу.
F = U – TS + PV, где U – полная внутренняя энергия вещества, Т – абсолютная температура, S – энтропия (вероятность пребывания вещества в данном состоянии)или показывает число способов, которыми система может придти в данное состояние, P – давление, V – объем. Свободная энергия с увеличением температуры уменьшается по кривой, так как теплоемкость жидкого состояния больше теплоемкости твердого состояния одного и того же вещества одинакового состава. При какой то t0 свободная энергия жидкого состояния и твердого будут равны и могут существовать сколь угодно долго. При повышении t> t0 вещество плавится, при понижении – кристаллизуется. В жидком металле атомы не расположены хаотично, как в газообразном состоянии, но в тоже время в их расположении нет той правильности, которая характерна для сложного кристаллического тела. Когда атомы сохраняют постоянные межпластинчатые расстояния и угловые соотношения на больших расстояниях, то это называется дальним порядком.
Микрообъемы, возникшие с правильным расположением атомов в жидком сплаве могут существовать некоторое время, а потом они рассасываются и возникают вновь в других местах. С понижением t размеры этих микрообъемов увеличиваются и постепенно металл кристаллизуется. Зародыши, возникшие в процессе кристаллизации могут быть разной величины. Зародыш может расти только в том случае, если он достиг определенной величины, начиная с которой его рост ведет к уменьшению энергии Гиббса. Минимальный размер зародыша, способный к росту при данных температурных условиях называется критическим размером зародыша.
9. Диаграмма Fe-C, Al-Cu, Cu-Zn.
Начало изучения диаграммы состояния системы железо – углерод (Fe-C) связано с открытием критических точек в стали Д. К. Черновым в 1868 г.
На рис. приведена полная диаграмма состояния системы
(стабильная система железо-углерод Fe—Сгр и метастабильная система железо - цементит Fe—FeC).
Метастабильная система Fe—Fe3C. Перитектическое превращение δ+ж↔γ протекает при 1494±2°С.
Предельная концентрация углерода в δ-фазе (точка Н) отвечает 0,1 % (по массе), или 0,46% (ат.).
Для точки A приняты значения 0,16% (по массе), или 0,74% (ат.), для точки В — значения 0,51% (по массе), или 2,33% (ат.). По данным термического анализа , линия ликвидус δ-фазы АВ — почти прямая, точке В соответствует 2,47% (ат.), предельная растворимость углерода в δ-Feсоставляет 0,5 % (эт.). Температура перитектической горизонтали равна 1496±2°С, точке 1 отвечает 0,18 % (но массе), или 0,83 % (эт.).
Кривая ликвидус аустенита ВС, установленная по данным Руэра, Хондо, Эдкока, Умино и др.
Предельная растворимость углерода в γ-Fe при 1147°С составляет 2,14% (по массе), или 9,2% (ат.) ; при 1150°С 2,02% (по массе), или 8,7 % (ат.).
Кривая ликвидус цементита CD экспериментально не фиксируется. Первичный цементит выделяется только при закалке расплавов, содержащих до 5,5 % (по массе) С, а при нагреве белых заэвтектических чугунов цементит разлагается до плавления (Fe3C->Fe+Crp) . По расчетным данным, виртуальная Температура плавления цементита оценивается равной 1200—1450 °С .
Возможно, цементит испытывает инконгруэнтное разложение при 1250—1300° С.
В высокоуглеродистых сплавах, содержащих более 6,7 % (по массе) С после закалки из жидкого состояния в медную изложницу и ледяную воду наблюдали только Fe3C; других карбидов не обнаружено . Таким образом, метастабильная система при нормальном давлении ограничена цементитом. При повышении давления стабилизируются высшие карбиды Fe7C3, Fe2C и Салм, однако при давлении 0,1 МПа выделение карбидов FeхC (Fe2C) наблюдали лишь при низкотемпературном отпуске закаленной стали.
Температура эвтектической горизонтали ECF принята равной 1147°С, эвтектике (точке С) соответствует 4,30%
(по массе), или 17,28 % (ат.) С .
Превращение у↔а (A3, кривая GS), исследованное многими авторами, также подтверждено последующими работами.
Эвтектоидная точка, находится при 723 °С и 0,76 % (по массе), или 3,44% (ат.). растворимость цементита в α-Fe(кривая PQ) очень мала и составляет 0,02% (по массе), или 0,095 % (ат.) растворимость цементита в a-Feпри 723 °С равна 0,025 % (по массе).
Кристаллическая структура. Феррит имеет о. ц. к. структуру a-Fe. Период решетки a-Feравен 0,2862 им при 20 °С и линейно возрастает до 0,2899 нм при 910 °С . При 769 °С (точка Кюри) ферромагнитное a-Feпереходит в «немагнитное α-Fe» (точнее, в упорядоченное антиферромагнитное β-Fe) . Вследствие малой растворимости углерода в a-Fe[0,02 % (по массе)] период решетки Тk-феррита практически такие же, как и чистого a-Fe. Атомы углерода в феррите занимают преимущественно октапоры. Выше 1392 °С γ-Fe превращается в парамагнитную δ-фазу, существующую при 1392—1536 °С. Период решетки о. ц. к. δ-Fe равен 0,2925 нм при 1392 °С и линейно растет до 0,2935 нм при 1536 °С . Температурная зависимость периода решетки для α-(β-) и γ-Fe различны. Период решетки δ-феррита с повышением температуры увеличивается сильнее, чем α (β)-фазы и, по-видимому, растет с увеличением содержания углерода.
Аустенит имеет г. ц. к. структуру γ-Fe. Период решетки γ-Fe линейно возрастает от 0,3637 нм при 911 °С до 0,368 нм при 1390 °С . углерод растворяется в γ-Fe в виде С4+ и занимает октапоры, образуя твердые растворы внедрения. С увеличением содержания углерода в аустените период решетки γ-фазы увеличивается.
Цементит Fe3C имеет ромбическую структуру .Периоды решетки: а=0,45244±0,0005 нм, b = 0,50885±0,0005 нм, с=0,67431± ±0,0005 нм; Температура перехода цементита из ферромагнитного в парамагнитное состояние (Тс) равна 215°С .
Карбид Fe7C3 получен только при высоких давлениях. Он имеет гексагональную структуру типа Сr7С3.
Периоды решетки а=0,6882 нм, с= 0,4540 нм. Установлено существование метастабильного карбида Fe2C
(ε-карбид), выделяющегося при отпуске стали. При 150—200°С из закаленной стали выделяется ε-карбид с гексагональной решеткой, имеющей периоды а=0,627 нм, с=0,214 нм. Высшие карбиды весьма неустойчивы и при построении диаграммы состояния при нормальных условиях не учитываются.

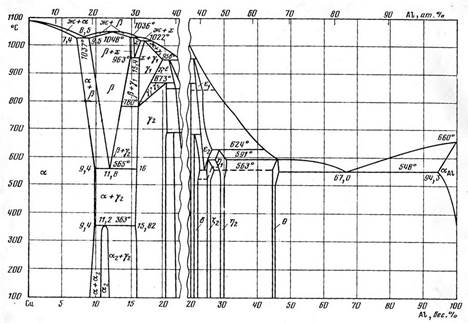
Диаграмма состояния системы медь—алюминий (Al-Cu) подробно исследована во всей области концентраций сплавов. Состав жидкой фазы в эвтектической точке соответствует 8,5 вес.% А1. При температурах 1036° и 1022° протекают перитектические реакции. Фаза х существует только в области высоких температур 1036—963°. Фаза β кристаллизуется из расплава по кривой с максимумом, который соответствует температуре 1048° и составу сплава, содержащего 12,4 вес.% Аl. В твердом состоянии имеет место несколько эвтектоидных и перитектоидпых превращений. При температуре 963° Фаза х распадается. В эвтектоидкой точке содержание алюниния соответствует 15,4 вес. %. Концентрационные пределы области гомогенности а2-фазы точно не установлены. Существование а2-фазы объясняет аномальный ход температурной кривой удельной теплоемкости при температуре около 300°, наблюдаемый в однофазных (а) и двухфазных сплавах.
Фаза a — твердый раствор на основе меди охватывает широкую область составов (до 9 вес. % Al), причем с понижением температуры растворимость алюминия в меди повышается. По данным измерения микротвердости при температурах 500, 700, 800 и 900° она составляет 9,4; 8,8; 8,2 и 7,8 вес.% соответственно. При 1037° растворимость Al в твердой меди составляет 7,4 вес.%
Фаза а имеет гранецентрированную кубическую решетку, аналогичную решетке чистой меди, параметр которой увеличивается с повышением содержания алюминия. Фаза β представляет собой твердый раствор на основе соединения Си3А1 (12,44 вес. % А1).
В системе Cu—Ζn существуют шесть фаз. Фаза (Cu) кристаллизуется из жидкости в интервале температур от температуры затвердевания Cu до 902 °С и при концентрациях до 36,8 % (ат.) Ζn. В твердом состоянии в области (Cu) установлены превращения, указывающие на образование соединения с формулой Cu3Zn, существующее в двух модификациях: α1 и α2 .
Фазы β, γ, δ, ε, (Ζn) образуются по перитектическим реакциям.
Область фазы β ограничена областью концентраций 36,1 % (ат.) Ζn при температуре 902 °С, 56,5 % (ат.) Ζnпри 834 °С; 48,2 % (ат.) Ζnпри 468 °С и 44,8 % (ат.) Ζnпри 454 СС. В интервале температур 454—468 °С происходит упорядочение фазы β: β ↔ β'. Фаза β' распадается по эвтектоидной реакции β' ↔ (Cu) + γ'" (НТ) при температуре -255 °С. Эвтектоидный распад фазы β' происходит при температуре выше100 °С.
Фаза γ имеет широкую область гомогенности, и максимально протяженность ее при температуре 558 °С составляет 13 % (ат), фаза γ существует в четырех модификациях но дотемператур 250—280 °С стабильна фаза γ'", выше 280 °С устойчива фаза γ", которая при температурах 550—650 °С переходит в фазу γ', выше 700 °С существует высокотемпературная модификация γ.
Фаза δ существует в узком температурном 700—558 °С и концентрационном интервалах и при температуре 558 °С претерпевает распад δ ↔γ" + ε.
Область ε фазы находится в пределах концентраций 78 % (ат) Ζn при температуре 597 °С и 87,5 % (ат.) Ζn при температуре 423 °С. Фаза ε стабильна до комнатной температуры. Растворимость Ζnв (Cu) сначала увеличивается от 31,9 % (ат) при температуре 920 °С до 38,3 % (ат.) при температуре 454 °С, а затем понижается и составляет 34,5 % (ат.) при температур. 150 °С и 29 % (ат.) при 0 °С. 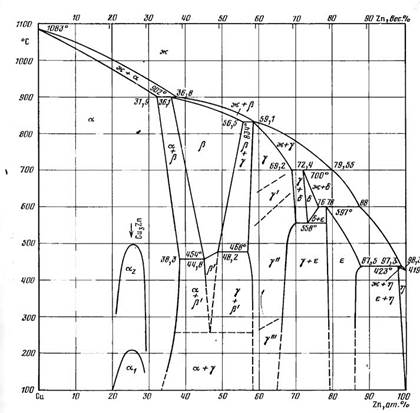
10. общая классификация металлических материалов.
Каждый металл отличается строением и свойствами от другого, тем не менее, по некоторым признакам их можно объединить в группы.
Данная классификация разработана русским ученым Гуляевым А.П. и может не совпадать с общепринятой.
Все металлы можно разделить на две большие группы – черные и цветные металлы.
Черные металлы чаще всего имеют темно-серый цвет, большую плотность (кроме щелочно-земельных), высокую температуру плавления, относительно высокую твердость. Наиболее типичным металлом этой группы является железо.
Цветные металлы чаще всего имеют характерную окраску: красную, желтую и белую. Обладают большой пластичностью, малой твердостью, относительно низкой температурой плавления. Наиболее типичным элементом этой группы является медь.
Черные металлы в свою очередь можно подразделить следующим образом:
1. Железные металлы – железо, кобальт, никель (так называемые ферромагнетики) и близкий к ним по свойствам марганец. Co, Ni, Mu часто применяют как добавки к сплавам железа, а также в качестве основы для соответствующих сплавов, похожих по своим свойствам на высоколегированные стали.
2. Тугоплавкие металлы, температура плавления которых выше, чем железа (т.е. выше 1539С). Применяют как добавки к легированным сталям, а также в качестве основы для соответствующих сплавов. К ним относят: Ti, V, Cr, Zr, Nb, Mo, Tc (технеций), Hf (гафий), Ta(тантал), W, Re (рений).
3. Урановые металлы – актиниды, имеющие преимущественное применение в сплавах для атомной энергетики. К ним относят: Ас(актиний), Th(торий), U(уран), Np(нептуний), Pu(плутоний), Bk(берклий), Cf (калифорний), Md(менделевий), No(нобелий) и др.
4. Редкоземельные металлы (РЗМ) – La(лантан), Ce(церий), Nd(неодим), Sm(санарий), Eu(европий), Dy(диспрозий), Lu(лютеций), Y(иттрий), Sc(сландий) и др., объединяемые под названием лантаноидов. Эти металлы обладают весьма близкими химическими свойствами, но довольно различными физическими (Тип. и др.). Их применяют как присадки к сплавам других элементов. В природных условиях они встречаются вместе и трудно разделимы на отдельные элементы. Обычно используется смешанный сплав – 40–45% Се (церий) и 40–45% всех других РЗМ.
5. Щелочноземельные металлы – в свободном металлическом состоянии не применяются, за исключением особых случаев, например, теплоносители в атомных реакторах. Li(литий), Na, K(калий), Rb(рубидий), Cs(цезий), Fr(франций), Ca(кальций), Sr(стронций), Ba(барий), Ra(радий).
Цветные металлы подразделяются на:
1. Легкие металлы – Ве(берилий), Mg(магний), Al(аллюминий), обладающие малой плотностью.
2. Благородные металлы – Ag(серебро), Pt(платина), Au(золото), Pd(палладий), Os(осмий), Ir(иридий), и др. Сu – полублагородный металл. Обладают высокой устойчивостью против коррозии.
3. Легкоплавкие металлы – Zn(цинк), Cd(кадмий), Hg(ртуть), Sn(олово), Bi(висмут), Sb(сурьма), Pb(свинец), As(мышьяк), In(индий) и т.д., и элементы с ослабленными металлическими свойствами – Ga(галий), Ge(германий).
Применение металлов началось с меди, серебра и золота. Так как они встречаются в природе в чистом (самородном) виде.
Позднее стали восстанавливать металлы из руд – Sn, Pb, Fe и др.
Наибольшее распространение в технике получили сплавы железа с углеродом: сталь (0,025–2,14% С) чугун (2,14–6,76% С); причина широкого использования Fe-C сплавов связано с рядом причин: малой стоимостью, наилучшими механическими свойствами, возможностью массового изготовления и большой распространенностью руд Fe в природе.
11. виды сталей и чугунов
| <== предыдущая страница | | | следующая страница ==> |
| | | Легированная сталь |
Дата добавления: 2015-07-26; просмотров: 494; Нарушение авторских прав

Мы поможем в написании ваших работ!