
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Практическая часть. Получение гидроксида железа (II) и изучение его свойств
Опыт 1.
а) Название эксперимента.
Получение гидроксида железа (II) и изучение его свойств.
б) Ход эксперимента.
В 3 ячейки капельного планшета поместим по 1 капле светло - салатового раствора сульфата железа (II) К каждой капле добавим по 1 капле раствора гидроксида натрия.
в) Наблюдения.
Выпадает салатовый осадок.
г) Уравнения реакции.
FeSO4 + 2NaOH = Fe(OH)2 ↓+ Na2SO4
 |  | 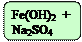 | |||||||
 |  | ||||||||
д) Иллюстрационный материал.
 |  | ||
е) Вывод.
При взаимодействии солей железа (II) со щелочами получается гидроксид железа (II) Fe(OH)2.
ж) Ход эксперимента.
После этого добавим к одной капле еще 2 капле гидроксида натрия NaOH, к другой 2 капли серной кислоты H2SO4, а третью оставим на воздухе O2.
з) Наблюдения.
Осадок растворяется лишь в ячейке с избытком кислоты и темнеет в присутствии кислорода воздуха.
и) Уравнения реакции.
Fe(OH)2 + NaOH = реакция не идет
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
4Fe(OH)2 + O2 = 2Fe2O3 + 4H2O
Fe+2 - 1ē = Fe+3 2 восстановитель реакция окисления
O20 + 2ē = 2O-2 1 окислитель реакция восстановлений
к) Иллюстрационный материал.
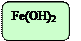 |  |  | |||||||
 |  | ||||||||
 |  | 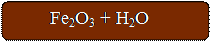 | |||||||
 |  | ||||||||
 |  |
л) Вывод.
Так как гидроксид железа (II) не растворяется в щелочи и растворяется в кислоте, то он является основным.
Опыт 2.
а) Название эксперимента.
Получение гидроксида железа (III) и изучение его свойств.
б) Ход эксперимента.
В две ячейки капельного планшета поместим по капле темно – желтого раствора хлорида железа (III) FeCl3. К каждой капле добавим по 1 капле раствора гидроксида натрия NaOH.
в) Наблюдения.
Выпадает янтарный осадок.
г) Уравнения реакции.
FeCl3 + 3NaOH = Fe(OH)3 ↓+ 3NaCl
 |  |  | |||||
 | |||||||
д) Иллюстрационный материал.
 |  |  | |||
е) Вывод.
При взаимодействии солей железа (III) с щелочами получается гидроксид железа (III) Fe(OH)3.
ж) Ход эксперимента.
После этого к одной капле добавим 2 капли раствора серной кислоты H2SO4, а ко второй еще 2 капли раствора гидроксида натрия NaOH.
з) Наблюдения.
В ячейке с кислотой осадок растворяется, в ячейке с избытком щелочи очень медленно происходит растворение осадка.
и) Уравнения реакции.
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Fe(OH)3 + NaOH = NaFeO2 + H2O
 |  | 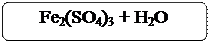 | |||||||
 |  | ||||||||
к) Иллюстрационный материал.
 |
 |  |  | |||||
 | |||||||
л) Вывод.
Так как гидроксид железе (III) растворяется в кислоте и растворяется в щелочи, то он является амфотерным.
Опыт 3.
а) Название эксперимента.
Качественные реакции на ионы Fe2+ и Fe3+.
б) Ход эксперимента.
В ячейку капельного планшета поместим 1 каплю раствора сульфата железа (II) FeSO4. Добавим 1 каплю гексацианоферрата (III) калия (красной кровяной соли) K3[Fe(CN)6].
в) Наблюдения.
Цвет раствора становится темно – синим.
г) Уравнения реакции.
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 3K2SO4
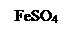 |  |  | |||||
 | |||||||
д) Иллюстрационный материал.
 |  |  | |||
е) Вывод.
Чтобы обнаружить ионы Fe2+ надо провести качественную реакцию с гексацианоферрата (III) калия (красной кровяной солью) K3[Fe(CN)6].
ж) Ход эксперимента.
В ячейку капельного планшета поместим 1 каплю темно – желтого раствора хлорида железа (III) FeCl3. Добавим к ней 1 каплю раствора гексацианоферрата (II) калия (желтой кровяной соли) K4[Fe(CN)6].
з) Наблюдения.
Цвет раствора становится темно – синим.
и) Уравнения реакции.
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl
 |  | 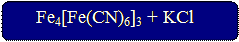 | |||||||
 |  | ||||||||
к) Иллюстрационный материал.
 |  |  | |||
л) Вывод.
Чтобы обнаружить ионы Fe3+ надо провести качественную реакцию с гексацианоферрата (II) калия (желтой кровяной солью) K4[Fe(CN)6].
Опыт 4.
а) Название эксперимента.
Окислительные свойства Fe3+.
б) Ход эксперимента.
В ячейку капельного планшета поместим 1 каплю темно – желтого раствора хлорида железа (III) FeCl3. Добавим 1 каплю раствора иодида калия KJ. Поместим в ячейку после этого крахмальную бумажку.
в) Наблюдения.
Цвет раствора становится оранжевым. Крахмальная бумажка окрашивается в синий цвет.
г) Уравнения реакции.
2FeCl3 + 2KJ = 2FeCl2 + J2 + 2KCl
Fe+3 + 1ē = Fe+2 2 окислитель
2J- - 2ē = J20 1 восстановитель
 |  |  | |||||||
 |  | ||||||||
д) Иллюстрационный материал.
 |
е) Вывод.
Окрас крахмальной бумажки в синий цвет указывает на присутствие свободного йода в растворе. Fe3+ является сильным окислителем.
Опыт 5.
а) Название эксперимента.
Получение гидроксида кобальта (II) и изучение его свойств.
б) Ход эксперимента.
В 3 ячейки капельного планшета поместим по 1 капле раствора хлорида кобальта (II) СоCl2. К каждой капле добавим по 1 капле раствора гидроксида натрия NaOH.
в) Наблюдения.
Выпадает синий осадок.
г) Уравнения реакции.
СоCl2 + 2NaOH = Co(OH)2 ↓+ 2NaCl
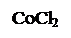 |  |  | |||||||
 |  | ||||||||
д) Иллюстрационный материал.
 |  | ||
е) Вывод.
При взаимодействии солей кобальта (II) с щелочами получается гидроксид кобальта (II) Co(OH)2.
ж) Ход эксперимента.
После этого добавим к одной капле еще 2 капле гидроксида натрия, к другой 2 капли серной кислоты, а к третьей 1 каплю пероксида водорода.
з) Наблюдения.
В ячейке с кислотой осадок растворился, в ячейке с избытком щелочи осадок ничего не произошло, в ячейке с пероксидом водорода - бурый осадок.
и) Уравнение реакции.
Со(OH)2 + NaOH = реакция не идет
Со(OH)2 + H2SO4 = СоSO4 + 2H2O
Со(OH)2 + Н2O2 = Со(OH)3
к) Иллюстрационный материал.
 |  |  | |||||||
 |  | ||||||||
 |  |  | |||||||
 |  | ||||||||
 |  |
л) Вывод.
Так как гидроксид кобальта (II) не растворяется в щелочи и растворяется в кислоте, то он является основным.
Опыт 6.
а) Название эксперимента.
Получение аммиаката кобальта (II).
б) Ход эксперимента.
В ячейку капельного планшета внесем 1 каплю раствора аммиака NH4ОН и 1 каплю розового раствора хлорида кобальта (II) СоCl2.
в) Наблюдения.
Выпадает голубой осадок.
г) Уравнения реакции.
CoCl2 + 2NH4ОН = Co(OH)2 ↓ + 2NН4Сl
д) Иллюстрационный материал.
 |  | 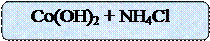 | |||||||
 |  | ||||||||
 |  | ||
е) Вывод.
При взаимодействии солей кобальта (II) с аммиаком получается гидроксид кобальта (II) Co(OH)2.
ж) Ход эксперимента.
Добавим до растворения осадка раствор аммиака.
з) Наблюдение.
Выпадает голубой осадок.
и) Уравнение реакции.
Co(OH)2 + 6NH4ОН = [Co(NH3)6](OH)2 + 6H2O
к) Иллюстрационный материал.
 |  |  | |||||||
 |  | ||||||||
 |  | ||
л) Вывод.
При взаимодействии гидроксида кобальта (II) с аммиаком получается аммиакат кобальта [Co(NH3)6](OH)2.
Опыт 7.
а) Название эксперимента.
Получение гидроксида никеля и изучение его свойств.
б) Ход эксперимента.
В 3 ячейки капельного планшета поместим по 1 капле раствора сульфата никеля (II) NiSO4 . К каждой капле добавим по 1 капле раствора гидроксида натрия NaOH.
в) Наблюдения.
Выпадает салатовый осадок.
г) Уравнения реакции.
NiSO4 + 2NaOH = Ni(OH)2 ↓+ Na2SO4
 |  |  | |||||||
 |  | ||||||||
д) Иллюстрационный материал.
 |  | ||
е) Вывод.
При взаимодействии солей никеля (II) с щелочами получается гидроксид никеля (II) Ni(OH)2.
ж) Ход эксперимента.
После этого добавим к одной капле еще 2 капле гидроксида натрия NaOH, к другой 2 капли серной кислоты H2SO4, а к третьей добавим раствор пероксида водорода H2O2.
з) Наблюдения.
Осадок не растворяется в ячейке с избытком щелочи и в ячейке с пероксидом.
и) Уравнения реакции.
Ni(OH)2 + NaOH = реакция не идет
Ni(OH)2 + H2SO4 = NiSO4 + 2H2O
Ni(OH)2 + H2O2 = реакция не идет
 | 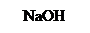 |
к) Иллюстрационный материал.
 |  |  | |||||||
 |  | ||||||||
 |  | 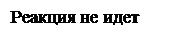 | |||||||
 |  | ||||||||
 |  |
л) Вывод.
Так как гидроксид никеля (II) не растворяется в щелочи и растворяется в кислоте, то он является основным.
Опыт 8.
а) Название эксперимента.
Получение аммиаката никеля.
б) Ход эксперимента.
В ячейку капельного планшета внесем 1 каплю аммиака NH4ОН и 1 каплю сульфата никеля (II) NiSO4.
в) Наблюдения.
Выпадает светло-голубой осадок.
г) Уравнения реакции.
NiSO4 + 2NH4ОН = Ni(OH)2 ↓ + (NН4)2SO4
д) Иллюстрационный материал.
 |  |  | |||||||
 |  | ||||||||
 |  | ||
е) Вывод.
При взаимодействии солей никеля (II) с аммиаком получается гидроксид никеля (II) Ni(OH)2.
ж) Ход эксперимента.
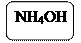
Добавим еще до растворения осадка 2 капли раствора аммиака NH4ОН.
з) Наблюдение.
Выпадает голубой осадок.
и) Уравнение реакции.
Ni(OH)2 + 6NH4ОН = [Ni(NH3)6](OH)2 + 6H2O
к) Иллюстрационный материал.
 |  |  | |||||||
 |  | ||||||||
 |  | ||
л) Вывод.
При взаимодействии гидроксида никеля (II) Ni(OH)2 с аммиаком NH4ОН получается аммиакат никеля [Ni(NH3)6](OH)2.
4. Контрольные вопросы.
1. Напишите уравнения двух реакций, при помощи которых можно различить в растворе ионы Fe2+ и Fe3+.
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 3K2SO4
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl
2. Какова степень окисления железа в солях K3[Fe(CN)6], Fe3[Fe(CN)6]2 K4[Fe(CN)6], Fe4[Fe(CN)6]3 ?
K3[Fe(CN)6] - +6;
Fe3[Fe(CN)6]2 - +2;
K4[Fe(CN)6] - +6;
Fe4[Fe(CN)6]3 - +3.
3. Приведите примеры комплексных соединений Co и Ni с координационными числами 4 и 6.
[Ni(NH3)6](OH)2 – для никеля
[Co(NH3)6](OH)2 – для кобальта
| <== предыдущая страница | | | следующая страница ==> |
| | | Основа работы «Faber.ua» |
Дата добавления: 2015-07-26; просмотров: 417; Нарушение авторских прав

Мы поможем в написании ваших работ!