
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Примеры коррозии
1. Консервная банка (луженое железо) представляет собой гальваническую пару железо–олово. Пока банка герметически закрыта, контактная пара не находится в среде, проводящей электрический ток, и банка может не подвергаться коррозии длительное время. Известен случай, когда консервная банка пролежала в земле около ста лет и не подверглась коррозии. Но стоит банку вскрыть, как незамедлительно начинается всепожирающий процесс коррозии. При этом электроны от железа, как более активного металла, переходят на олово. Между поверхностью оловянного покрытия и раствором возникает разность потенциалов. Ионы водорода из воды или кислоты собираются на поверхности малоактивного металла, где восстанавливаются с помощью электронов, идущих от растворяющегося железа. Чем более кислый раствор, тем коррозия интенсивней. В этом случае «работает» гальванический элемент. Железо служит растворимым анодом, а олово – катодом:
анод: Fe0 – 2e = Fe2+,
катод: 2Н+ + 2e = Н2  .
.
Ржавление железа – сложный процесс, в результате которого на поверхности образуется ржавчина. Упрощенный состав ржавчины, рыхлой массы красно-коричневого цвета, – гидроксид железа(III):
Fe2+ + 2OH– = Fe(OH)2  ,
,
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3  .
.
2. Основа оцинкованного ведра – железо, поверхность – серебристо-белый блестящий металл. По мере использования поверхность ведра покрывается буровато-беловатыми пятнами, разводами. Цинк в данной гальванической паре, как более активный металл, будет являться анодом и в присутствии среды, проводящей электрический ток, будет разрушаться, железо же не ржавеет. Поэтому оцинкованные ведра сравнительно недороги и служат долго.
Состав бело-бурых пятен – в основном гидроксид цинка. Химизм процесса:
анод: Zn0 – 2e = Zn2+,
катод: 2Н+ + 2e = Н2  .
.
Zn2+ + 2OH– = Zn(OH)2 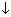 .
.
«Стригущий лишай цинковых покрытий» – это картина одного из видов коррозии цинка, внешне очень похожая на известное грибковое заболевание. Замечено, что в помещениях цинк корродирует быстрее, чем на открытой ветрам и дождям оцинкованной крыше. Происходит это потому, что продукты коррозии (оксид, гидроксид и карбонат цинка) не смываются дождями. Образовавшиеся отложения «белой ржавчины» впитывают влагу, и на оцинкованной поверхности разрастаются светлые пятна.
Интересно еще одно обстоятельство: мягкая вода вызывает более сильную коррозию этого металла, чем вода, содержащая в большом количестве соли жесткости. Жесткая вода действует менее агрессивно, т. к. осадок карбонатов образует на цинковой поверхности довольно прочное защитное покрытие.
Исходя из положения элемента в периодической системе, можно заранее сказать, какими химическими, а следовательно, и коррозионными свойствами он обладает. Под термином «коррозионные свойства» понимается, как легко данный элемент окисляется, какова устойчивость образующихся оксидов по отношению к воде, растворам солей и различных газов.
Так, в I группе в побочной подгруппе расположены металлы, весьма стойкие в коррозионном отношении. Это медь, серебро, золото, причем их коррозионная стойкость повышается с увеличением атомной массы.
Во II группе также более устойчивы металлы побочной подгруппы: цинк, кадмий, ртуть. На их поверхности в присутствии кислорода образуется тонкая, довольно прочная пленка оксидов, предохраняющая от дальнейшего процесса разрушения.
В III группе из технически важных металлов находится алюминий – это химически активный металл. Он легко окисляется кислородом воздуха, вследствие чего на его поверхности образуется тонкая стекловидная пленка. Но эта пленка обладает высокими защитными свойствами.
В IV группе находятся коррозионностойкие металлы – олово, свинец, стойкость которых тоже объясняется образованием прочных защитных пленок.
Металлы, находящиеся в четных рядах больших периодов, в V, VI и VII группах, обладают высокой способностью к пассивации, а следовательно, большой коррозийной стойкостью. Это ванадий, хром, кобальт и др.
Наиболее коррозионностойкие металлы находятся в VIII группе, причем чем больше их атомная масса, тем больше их устойчивость. Следовательно, из металлов VIII группы наиболее коррозионностойкие осмий, иридий и платина.
Знаменитая Эйфелева башня (7,3 тыс. т металлических конструкций) давно была бы уничтожена коррозией, если бы каждые 7 лет ее не покрывали краской. На окраску уже затрачены средства, превышающие стоимость самого сооружения.
Коррозия, подобно ненасытному дракону, сжирает миллиарды тонн железа и приносит громадный ущерб во всех странах. Никакие предохранительные покрытия, смазки, лаки, краски, использование сплавов не могут предотвратить болезни металлов – окисление, распыление, ржавление.
Все применяемые методы защиты металлов можно разделить на три группы:
1)различные покрытия;
2) обработка среды, в которой металлы находятся;
3) электрохимические методы защиты.



Использованы материалы сайтов:
Картинки:http://900igr.net/prezentatsii/khimija/Korrozija/011-Vidy-korrozii.html http://www.google.ru
Текст: http://him.1september.ru/articlef.php?ID=200400409 Автор печатного текста: В.Шефнер
Подобрала, правила и составила: Лукьянченко А.А.
Материал размещен в группе: http://vk.com/xum_bio
| <== предыдущая страница | | | следующая страница ==> |
| Электрохимическая коррозия | | | Дисциплина: обществознание |
Дата добавления: 2015-07-26; просмотров: 230; Нарушение авторских прав

Мы поможем в написании ваших работ!