
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Химические свойства. При растворении в воде образует азотную кислоту
Разложение:
2N2O5 = 4NO2 + O2.
При растворении в воде образует азотную кислоту:
N2O5 + H2O = 2HNO3.
Является сильным окислителем:
N2O5 + I2 = I2O5 + N2.
Аммиа́к — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине.
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2 + 3H2 ↔ 2NH3
Это так называемый процесс Габера
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O.
NH4NO3 + NaOH = NH3↑ + NaNO3 + H2O.
1. Реакции присоединения:
а) С водой: (реакция обратимая»)
NH3 + H2O = NH3*H2O
или NH3 + H2O = NH4OH
б) С кислотами:
NH3 + HCl = NH4Cl
NH3 + H2SO4 = NH4HSO4
2 NH3 + H2SO4 = (NH4)2SO4
в) С кислыми солями аммония (превращает в средние)
NH3 + NH4H2PO4 = (NH4)2HPO4
NH3 + NH4HSO4 = (NH4)2SO4
2. С кислородом:
4NH3 + 3О2 = 2N2 + 6H2O
4NH3 + 5О2 = 4NO + 6H2O
3. C хлором:
NH3 + 3Cl2 = 2N2 ↑ + 6HCl
4. С оксидом меди (II):
3CuO + 2 NH3 = 3Cu + N2 ↑ + 3H2O
5. C металлами:
2NH3 + 2Al = 2AlN +3H2
6. С углекислым газом
2 NH3 + CO2 = H2O + CO(NH2)2
7. Реакция разложения:
2 NH3 = N2 + 3H2
Гидрази́н (диамид) H2N—NH2 — бесцветная, сильно гигроскопическая жидкость с неприятным запахом. Ядовитый.
Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO:
NH3 + NaClO 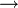 NH2Cl + NaOH
NH2Cl + NaOH
NH2Cl + NH3 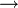 N2H4 · HCl,
N2H4 · HCl,
Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману:
H2NCONH2 + NaOCl + 2 NaOH 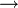 N2H4 + H2O + NaCl + Na2CO3,
N2H4 + H2O + NaCl + Na2CO3,
реакция проводится при температуре ~100 °C и атмосферном давлении.
В целом гидразин характеризуется восстановительными свойствами:
N2H4+O2=N2+2H2O (t)
2N2H4+4KMnO4+6H2SO4=5N2+4MnSO4+K2SO4+16H2O
Только очень сильные восстановители способны восстановить его до N(-3)
N2H4+Mg+4HCl=MgCl2+2NH4Cl
****ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ СОЛЕЙ АММОНИЯ:
NH4NO3=N2O+2H2O (250°)
2NH4NO3=2N2+O2+2H2O (400°)
NH4NO2=N2+2H2O (t)
(NH4)2Cr2O7=N2+Cr2O3+4H2O (t)
NH4Cl=NH3+HCl (t)
(NH4)2SO4=2NH3+H2SO4 (t)
*****Гидроксиламин (NH2OH) –кристаллическое ядовитое вещество, проявляющее преимущественно восстановительные свойства.
Получение: электрохимиичекски врсстанавливают раствор азотной кислоты, на катоде суммарно происходит реакция: HNO3+ 6H++6е= NH2OH+2H2O
Свойства:
NH2OH+2KMnO4+9H2SO4=5N2+2MnSO4+K2SO4+18H2O
2NH2OH+I2+2KOH=N2+2KI+4H2O
Промежуточная степень окисления атома азота объясняет диспропорционирование этого соединения при нагревании и способность восстанавливаться до иона NH4+
3NH2OH=N2+NH3+3H2O(t)
4KI+2NH2OH+3H2SO4=2I2+(NH4)2SO4+K2SO4+2H2O
NH2OH+HCl=[NH3OH]Cl
Азотистый водород (в растворе-азотистоводородная кислота) может быть получена следующим образом:
N2H4+HNO2=HN3+H2O
Соль этой кислоты-азид натрия-получают так:
2NaNH2+N2O=NaN3+H2O (200°)
Как окислитель HN3 в растворе имеет черты сходства с азоткой, например:
Cu+3HN3=Cu(N3)2+N2+NH3
Азиды щелочные и щелочноземельных металлов плавятся не разлагаясь и хорошо растворимы в воде, азиды тяжелых металлов при нагревании и даже от удара взрываются.
******ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С АЗОТНОЙ КИСЛОТОЙ
| Кислота | концентрация | Продукты реакции кислот с металлами | |||
| K,Ba,Ca,Na,Mg | Al,Cr,Fe | Zn,Sn | Cu,Hg,Ag | ||
| Азотная | Разбавленная | Соль+NH3+H2O | Соль+NO+H2O | Соль+NO+H2O | Соль+NO+H2O |
| концентрированная | Соль+N2O+H2O | Пассив. металла | Соль+NO2+H2O | Соль+NO2+H2O |
*******Смесь 3 объемов концентрированной соляной и 1 объема азотной кислоты называют «царской водкой». Это название отражает тот факт,что указанная смесь растворяет «царя металлов»- золото:
Au+4HCl+HNO3=H[AuCl4]+NO+2H2O
3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO+8H2O
3HgS + 8HNO3(конц.) + 6HCl(конц.) = 3HgCl2+ 3H2SO4 + 8NO↑ + 4H2O
********Соли азотной кислоты — нитраты — при нагревании необратимо разлагаются, продукты разложения определяются катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
2NaNO3 = 2NaNO2 + O2
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
2AgNO3 = 2Ag + 2NO2 + O2
г) нитрат аммония:
NH4NO3 = N2O + 2H2O
9. *Общая характеристика и химические свойства фосфора его получение в промышленности.
**Оксиды фосфора: получение, строение молекул и свойства.
***Фосфорноватистая и фосфористая кислоты: получение, строение молекул, кислотно-основные и окислительно-восстановительные свойства. Фосфиты и гипофосфиты.
****Кислоты фосфора (+5) и качественные реакции на них. Получение фосфорной кислоты в промышленности.
Описано 11 модификаций фосфора. Наибольший интерес представляют белый, красный и черный фосфор. Белый фосфор-мягкое, реакционноспособное очень токсичное вещество, хранят под слоем воды, так как на воздухе он самовоспламеняется. Белый фосфор представлен молекулами P4,имеющими форму тетраэдра и распадающимися при температурах выше 800 на молекулы состава P2.При длительном нагревании свыше 250 белый фосфор переходит в красный фосфор, который вполне устойчив на воздухе, не ядовит и воспламеняется только при нагревании свыше 400.Черный фосфор, являющийся наиболее устойчивой модификацией, получается из белого фосфора при высоком давлении. Черный фосфор жирен на ощупь, похож на графит, полупроводник не ядовит.
Из всех аллотропных модификаций фосфора за стандартное состояние принят белый фосфор, хотя он не является термодинамически наиболее стабильной модификацией.
Белый фосфор получают путем прокаливания фосфорной руды с коксом и кварцевым песком в электропечи: Ca3(PO4)2+5C+3Sio2=(t)=2P+3CaSiO3+5CO.
Химические свойства:
Валентные возможности атома фосфора по методу ВС 3 и 5,степени окисления в соединениях изменяются от -3 до +5,у атома фосфора в отличие от атома азота имеется возможность донорно-акцепторного механизма за счет свободных d-орбиталей.
Окисление фосфора ведет к двум оксидам P4O6 и P4O10,первый образуется при недостатке кислорода (избытке фосфора),а второй-при избытке кислорода.
P4+3O2(нед.)=P4O6
P4+5O2(изб.)=P4O10
В молекулах этих оксидов сохраняется тетраэдрическое строение молекулы белого фосфора. В оксиде P4O6 каждое ребро тетраэдра P4 «встраивается» атом кислорода, а в оксиде P4O10-еще и к каждому атому фосфора, находящемуся в вершинах тетраэдра, присоединяется по атому кислорода.
Фосфор реагирует сравнительно легко с серой, галогенами и другими неметаллами:
P4+6Г2(недост)=4PГ3
P4+10Г2(изб)=4PГ5
P4+10S=P4S10 (и другие соединения)
При спекании порошков металлов с фосфором образуются Фосфиды металлов
P4+6Zn=t=2Zn3P2
12K+P4=4K3P
Фосфор безразличен к водным растворам минеральных кислот. Медленно реагирует с кислотами-окислителями:
3P4+20HNO3(конц)+8H2O=12H3PO4+20NO
P4+20HNO3(конц)=4HPO3+20NO2+8H2O
P4+10H2SO4(конц)=4HPO4+10SO2+4H2O
В теплом растворе щелочи P4 диспропорционирует
P4+3NAOH+3H2O=PH3+3NaH2PO2
Фосфорноватистая кислота может быть получена
P4+3Ba(OH)2+6H2O=PH3+3Ba(H2PO2)2
Ba(H2PO2)2+H2SO4=BaSO4+2H3PO2
H3PO2-одноосновная, достаточно сильная
Соли фосфорноватистой кислоты называются гипофосфитами являются хорошими восстановителями,легко окисляются до соединений фосфора 3 и 5,находят применение для химической металлизации диэлектриков:
H3PO2+4AgNO3+2H2O=H3PO4+4Ag+4HNO3
2CuSO4+NaH2PO2+2H2O=2Cu+NaH2PO4+2H2SO4.
Ангидрида кислота H3PO2 не имеет.
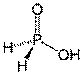
Фосфористая кислота, H2(PHO3), двухосновная в водных растворах, а формально трёхосновная кислота средней силы.
P4O6+6H2O(холод)=4H3PO3
7P4O6+30H2O(гор)=2PH3+2P4+18H3PO4
H3PO3+Cl2+H2O=2HCl+H3PO4
Na2HPO3+2AgNO3+H2O=Na2HPO4+2Ag+2HNO3
 Фосфиты являются неплохими восстановителями, в ОВР окисляются до соединений фосфора 5
Фосфиты являются неплохими восстановителями, в ОВР окисляются до соединений фосфора 5
H3PO3+Cl2+H2O=2HCl+H3PO4
Na2HPO3+2AgNO3+H2O=Na2HPO4+2Ag+2HNO3
P4O10+2H2O=4HPO3(мета)
2HPO3+H2O=H4P2O7(пиро)
H4P2O7+H2O=2H3PO4(орто)
Растворы мета- и пирофосфорной кислот достаточно трудно отличить,до сих пор для определения этих кислот используется буквально старинный рецепт мета-сворачивает яичный белок,пиро-нет.
Н3РО4 + 3AgNO3 = Ag3PO4 + 3HNO3
Качественной реакцией на ион РО43− является образование ярко-жёлтого осадка молибденофосфата аммония:
H3PO4 + 12(NH4)2MoO4 + 21HNO3 = (NH4)3PMo12O40·6H2O + 21NH4NO3 + 6Н2О
Получение в промышленности
4Р + 5О2 = Р4О10
Р4О10 + 6Н2О = 4Н3РО4
10. *Общая характеристика и химические свойства мышьяка, сурьмы и висмута.
**Сульфиды мышьяка, сурьмы и висмута: их отношение к кислотам и к раствору сульфида аммония. ***Тиокислоты и их соли.
****Галогениды мышьяка, сурьмы и висмута: их получение и гидролиз. Тиокислоты и тиосоли.
Мышьяк,сурьма,висмут.
Мышьяк и сурьма имеют ряд аллотропных модификаций. Наиболее устойчивы металлические формы серого(As) и серебристо-белого(Sb)цвета.Это хрупкие в-ва. Висмут- Ме серебристо-белого цвета с едва заметным розовым оттенком. Менее хрупок,чем сурьма. В подгруппе сверху вниз более стабильными становятся соед. ст.ок. +3.В целом для этих элементов хар-ны ст.ок. от -3до+5 .Встречаются в основном в виде сульфидов. Преимущественный способ получения:
Сульфид(обжиг)→ Оксид(оС,t)→ Элемент
Хим.св-ва:
Реакции простых веществ с серной к-той:
4As+6H2SO4(конц)=As4O6+6SO2+6H2O
2Sb+6H2SO4(конц)=Sb2(SO4)3+3SO2+6H2O(Bi)
Bi пассивируется в HNO3(конц). Взаимодействие простых веществ с азоткой:
As+5HNO3(конц)=H3AsO4+5NO2 + H2O
2Sb+10HNO3(конц)=Sb2O5+10NO2+5H2O
As+HNO3(разб)+H2O=H3AsO3+NO
4Sb+4HNO3(разб)=Sb4O6+4NO+2H2O
Bi+4HNO3(разб)=Bi(NO3)3+NO+2H2O
Металлические Sb и Bi могут реагировать с HCl(конц)в присутствии окислителя
2Sb + 12HCl + 3H2O2 = 2H3[SbCl6] + 6H2O.
В природе As, Sb и Bi встречаются в виде сульфидов.
Крайне редко эти элементы встречаются в самородном виде. Природные сульфиды обжигают и образовавшиеся оксиды восст.коксом:
2As2S3 + 9O2 = 2As2O3 + 6SO2,
2As2O3 + 2C = As4+ 3CO.
При комнатной температуре As, Sb и Bi реагируют только с галогенами, образуя тригалогениды(ЭГ3), а в случае сурьмы и пентагалогениды(ЭГ5). ). При спекании As, Sb и даже Bi с порошком активных Ме, образуются арсениды, антимониды и висмутиды.(Ca3As2,K3Sb)
**Сульфиды: (Э2S3 и Э2S5 )
Получают взаимодействием простых веществ, либо взаимодействием соответствующих соединений в сильно кислой среде с H2S:
2As + 3S →As2S3
2Na3AsO4+6HCl+5H2S=As2S5↓+6NaCl+8H2O
Bi2S3 – сульфид, остальные соединения – тиоангидриды. Имеют очень маленькие значения ПР, нерастворимы в мин. кислотах. Эти соед. можно перевести в растворимое состояние либо действием кислот-окислителей, например:
Sb2S3+28HNO3(конц.)= Sb2O5+28NO2+3H2SO4+11H2O
Bi2S3+24HNO3(конц.)= Bi2(SO4)3+ 24NO2 +12H2O
Либо в щелочных растворах:
Sb2S3+6KOH=K3SbS3+K3SbO3+3H2O
Sb2S5+8KOH=K3SbS4+K3SbO4+K2S+4H2O
Sb2S5+16KOH=2K3SbO4+5K2S+8H2O
Сульфиды As, Sb и Bi проявляют некоторую аналогию свойств с оксидами тех же элементов. Подобно тому, как оксиды As и Sb при взаимодействии со щелочами дают соли кислот Н3ЭО3 или Н3ЭО4, сернистые их производные обр. с растворимыми сульфидами Ме соли соответствующих тиокислот (аналог для сульфидасурьмы)
3 (NH4)2S + As2S3 = 2 (NH4)3AsS3 и
3 (NH4)2S + As2S5 = 2 (NH4)3AsS4
Bi2S3 с растворимыми сернистыми солями практически не реагирует. Сульфид этот, следовательно, ведёт себя аналогично почти нерастворимому в щелочах оксиду (Bi2O3).
****Галогениды:
Галогениды As, Sb и Bi легко образуются при прямом взаимодействии элементов. Галогениды типа ЭГ3 известны для всех рассм-ых эл-в и Hal, галогениды типа ЭГ5 более или менее устойчивы лишь производные фтора и SbCl5
Галогениды ЭГ3 и ЭГ5 сильно гидролизованы в водных растворах; AsCl3 и SbCl5 – практически нацело:
AsCl3+2H2O=HAsO2+3HCl
2SbCl5+5H2O=Sb2O5+10HCl
Галогениды Sb(III) и соли Bi(III) подвергаются гидролизу с образованием малорастворимых оксосолей:
SbCl3+H2O=SbOCl↓(хлористый антимонил)+2HCl
Bi(NO3)3+H2O=BiONO3↓(нитрат висмутила) +2HNO3
BiI3 растворим в избытке йодида, при этом образуется непрочный комплекс, разрушаемый даже разбавлением раствора:
BiI3+KI(изб)=K[BiI4]
Ион Bi3+ способен в растворе восстанавливаться до металла:
3K2[Sn(OH)4]+2Bi(NO3)3+6KOH=3K2[Sn(OH)6]+2Bi↓+6KNO3
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства. Оксид азота, и мономер, и димер, хорошо растворим в воде, и взаимодействует с ней | | | Реакции пероксида водорода в роли окислителя и восстановителя |
Дата добавления: 2015-07-26; просмотров: 837; Нарушение авторских прав

Мы поможем в написании ваших работ!