
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Методы получения
1. Замещение атомов водорода в углеводородах на галоген.
Таким образом галогенируют алканы, циклоалканы, бензол и его гомологи, алкены.
В частности, хлорирование метана широко применяется в промышленности. Реакция идет на свету (под действием УФ-облучения; hv) и в темноте (при нагревании 250-4000С или в присутствии катализаторов - хлориды меди, сурьмы, олова или йод). При этом газообразный хлор последовательно замещает в молекуле метана все четыре атома водорода с образованием соответствующих галогенопроизводных:
CH4 + Cl2 → CH3Cl + HCl
метан хлорметан
(хлористый метил)
CH3Cl + Cl2 → CH2Cl2 + HCl
дихлорметан
(хлористый метилен)
CH2Cl2 + Cl2 → CHCl3 + HCl
трихлорметан
(треххлористый углерод, хлороформ)
CHCl3 + Cl2 → CНCl4 + HCl
тетрахлорметан
(четыреххлористый углерод)
В реакциях с алканами галогены располагаются по своей реакционной способности в следующем порядке:
F > Cl > Br > I
При этом фтор реагирует с алканами очень активно и реакции обычно сопровождаются взрывами, а йод вообще не взаимодействует, так как образующийся HI является очень сильным восстановителем и восстанавливает образовавшееся иодпроизводное снова до углеводорода.
Галогенирование алканов как под действием света (реакция металепсии),так и при высоких температурах протекает по радикально-цепному механизму и является реакцией радикального замещения (SR):
на стадии I при УФ-облучении (фотохимическое галогенирование) или повышенных температурах (термическое галогенирование) молекулы галогена распадаются на радикалы:
hν; tºC
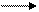 I. Cl : Cl Cl • + Cl • - инициирование (зарождение) цепи
I. Cl : Cl Cl • + Cl • - инициирование (зарождение) цепи
На стадии II и III происходит исчезновение одних и появление других свободных радикалов.
 |


 II. СН4 + Сl • •CН3 + НCl развитие
II. СН4 + Сl • •CН3 + НCl развитие
(рост) цепи

 III. • СН3 + Cl : Cl CH3Cl + Cl•
III. • СН3 + Cl : Cl CH3Cl + Cl•
Рост цепи продолжается до тех пор пока не прекратят свое существование свободные радикалы. При отсутствии свободных радикалов в реакционной смеси происходит обрыв цепи – IV. На стадии IV возможны разные варианты соединения радикалов, содержащихся в реакционной смеси.


 IV. • СН3 + Cl • CH3Cl; Cl • + Cl • Cl2; • СН3 + • СН3 СН3 - СН3
IV. • СН3 + Cl • CH3Cl; Cl • + Cl • Cl2; • СН3 + • СН3 СН3 - СН3
Аналогично идет, например, хлорирование этана:
СН3 - СН3 + Сl2 → Н3С – СН2Сl + НСl
Однако прямое хлорирование алканов с большей длиной углеродной цепи приводит к смеси продуктов, выделение из которой целевого хлорпроизводного является сложной задачей, в частности:
hv
 СН3 – СН2 – СН3 + Сl2 CH3 – CH2 – CH2Cl + CH3 – CH – CH3 + HCl
СН3 – СН2 – СН3 + Сl2 CH3 – CH2 – CH2Cl + CH3 – CH – CH3 + HCl
 пропан 1-хлорпропан
пропан 1-хлорпропан
Cl
2-хлорпропан
Галогенирование циклоалканов происходит в тех же условиях:
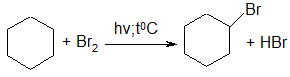
циклогексан бромциклогексан
(циклогексилбромид)
Бензол и его гомологи галогенируются (хлорируются) легче, чем алканы. Так, на холоду и в присутствии катализаторов (AlCl3, FeCl3) галоген замещает атомы водорода в бензольном кольце, а при нагревании или на свету без катализатора замещаются атомы водорода в боковой цепи:

1 – о-хлортолуол, 2 – п-хлортолуол, 3 – бензилхлорид, 4 – бензилиденхлорид, 5 – бензотрихлорид
Реакция идёт в газовой среде (пропускание хлора в парах толуола)
При высокой каталитической активности AlCl3 в процессе хлорирования бензола все атомы водорода могут быть замещены на галоген:
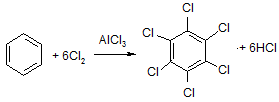
бензол гексахлорбензол
Под действием ультрафиолетового излучения без катализатора к молекуле бензола может присоединяться три молекулы хлора или брома:
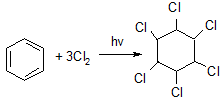
бензол гексахлорциклогексан (гексахлоран) –
промышленный способ получения
При высоких температурах (400-6000С) атомы водорода в алкенах замещаются на атомы галогена, не затрагивая двойной связи:
tºC
 СН2 = СН – СН3 + Сl2 CH2 = CH – CH2Cl + HCl
СН2 = СН – СН3 + Сl2 CH2 = CH – CH2Cl + HCl
пропилен аллилхлорид
2. Присоединение галогенов к ненасыщенным углеводородам в среде растворителя при комнатной температуре, в темноте (галогенирование алкенов):
 СН2 = СН2 + Br2 СН2Br – CH2Br
СН2 = СН2 + Br2 СН2Br – CH2Br
этилен 1,2 – дибромэтан
Механизм реакции начинается электрофильной атакой двойной связи молекулой брома. Молекула галогена поляризуется под влиянием π-электронов двойной связи и конечный атом Br, несущий частичный положительный заряд δ+, выступает как электрофильный агент, захватывая π- электроны двойной связи с образованием неустойчивого π- комплекса (I).

 +
+



 медленно СН2 – СН2 Н2С – CH2 быстро
медленно СН2 – СН2 Н2С – CH2 быстро





 СН2 = СН2 + Br2 CH2 = СН2 или + + Br- → СН2-СН2
СН2 = СН2 + Br2 CH2 = СН2 или + + Br- → СН2-СН2

 Вr: Вr Br Br
Вr: Вr Br Br
Br δ+ - Brδ - карбокатион ион бромония 1,2-дибромэтан
π –комплекс (δ-комплекс) (бромониевый катион)
I II III
Затем двойная связь и связь между атомами галогена разрываются гетеролитически с образованием δ-комплекса (II) или бромониевого катиона (III), из которых под действием аниона Br- быстро образуется 1,2-дибромэтан.
3. Присоединение галогеноводородов к ненасыщенным углеводородам
(гидрогалогенирование):
 CH2 = CH2 + HBr CH3 – CH2Br
CH2 = CH2 + HBr CH3 – CH2Br
этилен бромэтан

 + НCl CH2 = CHCl
+ НCl CH2 = CHCl
ацетилен винилхлорид
К несимметричным олефинам галогеноводороды присоединяются по правилу Марковникова т.е. водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода, а галоген - к другому ненасыщенному углеродному атому:
 СН3 – СН = СН2 + НCl CH3 – CH – CH3
СН3 – СН = СН2 + НCl CH3 – CH – CH3

Cl 2-хлорпропан
Механизм реакции подтверждает правило Марковникова:
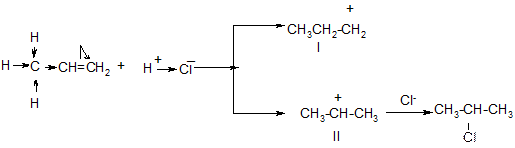
I –энергетически не выгодный малоустойчивый карбкатион, т.к. положительный заряд компенсируется +I эффектом только одного радикала. II – энергетически выгодный устойчивый карбкатион, т.к. положительный заряд на С2 – атоме компенсируется +I эффектом двух СН3 – групп. Поэтому реакция идёт через устойчивый карбкатион II.
Необходимо отметить, что правило Марковникова соблюдается только при гетеролитическом механизме присоединения галогеноводородов к алкенам (АЕ). В присутствии перекисей (что характерно только для НBr) эти реакции протекают по радикальному механизму вопреки правила Марковникова (перекисный эффект Хараша):
НBr
 СН3 – СН = СН2 CH3 – CH2 – CH2Br
СН3 – СН = СН2 CH3 – CH2 – CH2Br
H2O2 1 - бромпропан
механизм реакции:
 2 НBr + O2 2Br • + H2O2; HBr + H2O2 Br • + [H3O2] •
2 НBr + O2 2Br • + H2O2; HBr + H2O2 Br • + [H3O2] •

 CH3 – CHBr –CH2•
CH3 – CHBr –CH2•
CH3 – CH = CH2 +Br •→ I
НBr

 CH3–CH–CH2Br CH3 – CH2 – CH2Br + Br• и т.д.
CH3–CH–CH2Br CH3 – CH2 – CH2Br + Br• и т.д.
II
I. менее устойчивый радикал т.к. свободный электрон вступает во
взаимодействие с электронным облаком только одной соседней С – Н
связи.
II. устойчивый радикал т.к. свободный электрон вступает во взаимодействие с
электронными облаками пяти соседних связей С – Н.
4. Получение галогенопроизводных из спиртов.
При действии на спирты галогеноводородом, пятихлористым фосфором (РСl5) или хлористым тионилом (SOCl2) гидроксильная группа замещается на атом галогена:
tºC,CaCl2
 С2Н5ОН + НСl C2H5Cl + H2O
С2Н5ОН + НСl C2H5Cl + H2O
этанол этилхлорид
(хлористый этил)
 С2Н5ОН + РCl5 C2H5Cl + РОСl3 + HCl
С2Н5ОН + РCl5 C2H5Cl + РОСl3 + HCl
пятихлористый хлорокись
фосфор фосфора
 С2Н5ОН + SOCl2 C2H5Cl + SO2↑ + HCl↑
С2Н5ОН + SOCl2 C2H5Cl + SO2↑ + HCl↑
хлористый
тионил
При использовании в качестве галогенирующего реагента галогеноводорода необходимо применять водоотнимающее средство (например CaCl2), которое связывает образующуюся воду и предотвращает гидролиз полученных галогеноалкилов.
В реакциях с РСl5 в качестве побочного продукта образуется хлорокись фосфора- жидкое вещество как и целевой продукт С2Н5Сl. Поэтому разделение этих двух жидкостей составляет дополнительные технологические трудности.
Наиболее удобно использовать в этих реакциях хлористый тионил, так как побочные продукты SO2 и НСl являются газообразными веществами, которые легко удаляются от основного продукта C2H5Cl.
| <== предыдущая страница | | | следующая страница ==> |
| Изомерия и номенклатура | | | Химические свойства. Галогенопроизводные углеводородов являются одним из наиболее реакционноспособных классов органических соединений |
Дата добавления: 2015-07-26; просмотров: 553; Нарушение авторских прав

Мы поможем в написании ваших работ!