
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Методика приготовления раствора сульфита натрия для анализа
Химические реактивы:
1.вода дистиллированная
2.серная кислота, H2SO4, 2н раствор;
3.перманганат калия, KMnO4, стандартный раствор метода, установленной концентрацией;
4.образец для анализа, Na2SO3, сульфит натрия;
Посуда и оборудование:
1.коническая колба, емкостью 250-300мл;
2.мерная колба, емкостью 100,00мл;
3.мерный цилиндр;
4.химическая воронка;
5.часовое стекло;
5.промывалка;
Навеску сульфита натрия с точностью до 0,0002г в пределах ± 10% от рассчитанного количества, точно взвесить на часовом стекле на аналитических весах (второго класса точности). Количественно перенести через воронку в мерную колбу (часовое стекло и воронку обмыть холодной дистиллированной водой с помощью промывалки). Растворить образец в небольшом количестве холодной дистиллированной воды, разбавив в последствии раствор в колбе до метки. Закрыть мерную колбу пробкой, тщательно перемешать раствор в колбе.
4.Методика определения массовой доли сульфита натрия Na2SO3 в техническом образце.
Бюретку ополаснуть раствором Na2SO3, затем заполнить бюретку раствором Na2SO3 до 0 (носик бюретки должен быть заполнен раствором Na2SO3) .
Коническую колбу ополаснуть дистиллированной водой. Пипетку ополаснуть раствором KMnO4. Пипеткой отбрать аликвоту стандартного раствора метода (10,00 мл) KMnO4 и перенести в коническую колбу. В коническую колбу прилить 30мл 2н раствора H2SO4 и перемешать реакционную смесь.
Кислый раствор KMnO4 (в титровальной колбе) оттитровать раствором Na2SO3 до перехода розово-фиолетовой окраски раствора перманганата калия от 1 капли сульфита натрия в бесцветную. Титрование повторить не менее 3-х раз. Вычислить средний объём Na2SO3, пошедший на титрование аликвотной части раствора KMnO4.
5.Вычисление массовой доли сульфита натрия Na2SO3 в техническом образце
Задача: Навеску технического сульфита натрия массой 0,3968г количественно перенесли и растворили в мерной колбе ёмкостью 100мл. На титрование 10,00мл подкисленного раствора KMnO4 израсходовано 9,25мл приготовленного раствора Na2SO3 (средний объём). Концентрация стандартного раствора метода равна Сн (KMnO4) =0,05103 моль/л. Вычислить массовую долю Na2SO3 в техническом образце.
| Дано: Сн (KMnO4) =0,05103 моль/л mн = 0,3968 г Vк = 100 мл Vп (KMnO4)= 10,00 мл V (Na2SO3) = 9,25 мл Мэ (Na2SO3) = М/2 = 63,02 г/моль Мэ (KMnO4) = М/5 = 31,61 г/моль | 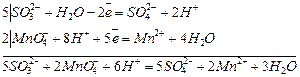 1.вычислим по результатам титрования нормальную концентрацию сульфита натрия.
1.вычислим по результатам титрования нормальную концентрацию сульфита натрия.
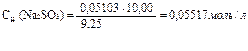 Вопрос к строчке: Сколько моль-экв Na2SO3 содержится в 1л раствора?
2.рассчитаем массовую долю сульфита натрия в образце
Вопрос к строчке: Сколько моль-экв Na2SO3 содержится в 1л раствора?
2.рассчитаем массовую долю сульфита натрия в образце
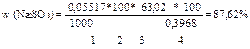 Вопрос к строчке:
1.Сколько моль-экв Na2SO3 содержится в 1 мл раствора?
2.Сколько моль-экв Na2SO3 содержится в 100 мл раствора?
3.Сколько г Na2SO3 в 100 мл раствора, столько же г Na2SO3 содержится в навеске.
4.Сколько г Na2SO3 содержится в 100 г образца или w (Na2SO3)?
Вопрос к строчке:
1.Сколько моль-экв Na2SO3 содержится в 1 мл раствора?
2.Сколько моль-экв Na2SO3 содержится в 100 мл раствора?
3.Сколько г Na2SO3 в 100 мл раствора, столько же г Na2SO3 содержится в навеске.
4.Сколько г Na2SO3 содержится в 100 г образца или w (Na2SO3)?
|
| w (Na2SO3)-? |
| <== предыдущая страница | | | следующая страница ==> |
| Лабораторная работа №6. Метод титриметрического анализа: редоксиметрия, метод перманганатометрии | | |
Дата добавления: 2015-07-26; просмотров: 275; Нарушение авторских прав

Мы поможем в написании ваших работ!