
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Порядок выполнения работы. Перед началом работы следует внимательно изучить правила пользования бюреткой и правила титрования (см
Перед началом работы следует внимательно изучить правила пользования бюреткой и правила титрования (см. приложение).
Титрование тетрабората натрия соляной кислотой можно представить следующим уравнением:
Na2B4O7 + 2HCl +5H2O → 2NaCl + 4H3BO3
2Na+ + B4O72– + 2H+ + 2Cl– +5H2O → 2Na+ + 2Cl– +4H3BO3
B4O72– + 2H+ +5H2O → 4H3BO3
Тетраборат натрия – это соль, образованная катионом сильного основания и анионом слабой кислоты, поэтому ее раствор имеет сильно щелочную реакцию. Титрование ведут в присутствии индикатора метилового красного, интервал перехода которого 4,4 – 6,2.
Бюретку укрепляют в штативе в строго вертикальном положении, сливают дистиллированную воду и споласкивают рабочим раствором соляной кислоты. Затем бюретку наполняют раствором соляной кислоты выше нулевой отметки, заполняют носик раствором и устанавливают уровень кислоты на нулевое деление, сливая избыток кислоты в стакан.
Тщательно вымытую пипетку дважды ополаскивают приготовленным стандартным раствором буры и переносят в чистую колбу для титрования. Добавляют 2–3 капли индикатора метилового-красного (раствор приобретает бледно-желтую окраску).
В колбу для титрования прибавляют по несколько капель соляной кислоты из бюретки, непрерывно перемешивая жидкость плавными круговыми движениями. Титрование продолжают до перехода окраски раствора из желтой в бледно-розовую от одной капли. Титрование повторяют 3–5 раз, расхождение в результатах не должно превышать 0,05 мл. После каждого титрования оттитрованный раствор выливают, колбу ополаскивают дистиллированной водой и набирают новую аликвотную часть.
Полученные результаты титрования и результаты статистической обработки (7, 8, 9) заносят в таблицу 4.1:
Таблица 4.1 – Результаты титрования тетрабората натрия соляной кислотой
| число опытов (n) | V(Na2B4O7), мл | V(HCl), мл (Vi) | V(HCl)ср, мл | (Vi–Vср.) | (Vi–Vср.)2 | s2 | s | ±e |
Расчет среднего объема, пошедшего на титрование, проводят по уравнению6:
 6
6
где V1, V2, V3, Vn – объемы титранта, пошедшие на титрование, n – число полученных объемов.
_____________________________________________________________________________________
Статистическая обработка полученных результатов.
Ход статистической обработки:
1. Рассчитывают дисперсию (s2): 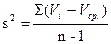 7
7
2. Рассчитывают стандартное отклонение (s): 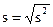 8
8
3. Находят доверительный интервал (±e):  9
9
(здесь t0,05 – коэффициент Стьюдента для доверительной вероятности 95%, табл. 4.2)
Таким образом, объем пошедший на титрование равен Vср.±e
По закону эквивалентов рассчитывается нормальная концентрация соляной кислоты:
Сн(HCl) · V(HCl) = Сн(Na2B4O7) · V(Na2B4O7),
 =
=
Полученное значение концентрации соляной кислоты записывают в рабочий журнал и на этикетку склянки для хранения HCl.
4.4 Результаты работы:
_____________________________________________________________________________________
Дата добавления: 2015-07-26; просмотров: 390; Нарушение авторских прав

Мы поможем в написании ваших работ!