
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Теоретические основы кислотно-основных реакций
Лекция 5
Кислотно-основное титрование
Список рекомендуемых источников:
1. Васильев В.П. Аналитическая химия : В 2 кн. : Кн. 1 : Титриметрические и гравиметрические методы анализа : учеб. для студ. вузов, обучающихся по химико-технол. спец. – 4-е изд., стереотип. – М. : Дрофа, 2004. – 368 с. (С. 68 – 82).
2. Основы аналитической химии : В 2 кн. : Кн. 2 : Общие вопросы. Методы разделения : учеб. для вузов / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева и др. Под ред. Ю.А. Золотова. – 2-е изд., перераб. и доп. – М. : Высш. шк., 2000. – 494 с. (С. 29 – 40).
Теоретические основы кислотно-основных реакций
Согласно теории Аррениуса – Оствальда, кислотой называется электронейтральное вещество, которое при растворении в воде диссоциирует с образованием иона водорода Н+, а основанием – вещество, которое диссоциирует с образованием иона ОН–.
Однако эта теория имеет ряд недостатков по отношению ко многим водным и неводным растворам. Например, в бензольных растворах HCl нельзя обнаружить никаких ионов, в том числе и Н+, однако металлы в этом растворе растворяются с выделением водорода, кислотно-основные индикаторы изменяют свой цвет так же как под действием кислоты. Соли слабых кислоты проявляют в водных растворах свойства оснований (Na2CO3, KCN, Na3PO4 и т.д.), а кислые соли часто выступают как кислоты (NaH2PO4, KHSO4 и т.д.).
Согласно протолитической теории Бренстеда – Лоури, кислотой называют вещества, способные отдавать протон другому веществу, а основаниями – вещества, способные принимать протон.
Отсюда, к кислотам можно отнести NH4+, HSO4–, а к основаниям – СО32–, РО43–.
Все реакции кислотно-основного взаимодействия по этой теории состоят в обратимом переносе протона от кислоты к основанию:
НА + В ↔ НВ+ + А–
кислота основание сопряженная сопряженное
кислота основание
Например:
НСN + OH– ↔ НOH + CN–
кислота основание сопряженная сопряженное
кислота основание
Соединения, которые могут быть как кислотами, так и основаниями, называются амфипротными (амфолитами). Например, вода, продукты ступенчатой диссоциации многоосновных кислот (НРО42–, НС2О4– и т.д.).
Согласно теории Льюиса, кислоты – это частицы, с незаполненной внешней электронной оболочкой – акцепторы электронной пары, а основания – частицы со свободной парой электронов – доноры электронной пары. Происходит обобществление электронной пары основания. К кислотам Льюиса относятся катионы металлов, молекулы типа BF3, SO3, SnCl4, TiCl4 и др.
Одно из основных возражений против теории Льюиса заключается в том, что в этой теории для отнесения вещества к кислоте или основанию используется механизм его образования, что ставит классификацию в тесную зависимость от взглядов на природу химической связи.
Способность кислоты отдавать протон, а основания принимать его (т.е. силы кислот и оснований) можно охарактеризовать константами равновесий, которые называют соответственно константой кислотности Ка и константой основности Кb.
НА + НS ↔ SH2+ + A–

B + HS ↔ S– + BH+

где НА – кислота, В – основание, HS – растворитель.
Константы выражены с учетом постоянства активности растворителя.
Одним из компонентов протолитической реакции может быть растворитель. С точки зрения кислотно-основных свойств растворители можно разделить на 3 группы:
1) апротонные растворители, не обладающие ни кислотными, ни основными свойствами (углеводороды и их галогенопроизводные – бензол, гексан, хлороформ);
2) протофильные растворители, обладающие только основными свойствами (кетоны – ацетон, простые эфиры – диоксан, диэтиловый эфир, третичные амины – пиридин);
3) амфипротные растворители, обладающие как кислотными, так и основными свойствами (вода, спирты, карбоновые кислоты, первичные и вторичные амины).
Вода в чрезвычайной малой степени диссоциирует:

Процесс диссоциации, протекающий самопроизвольно, при котором одна молекула растворителя проявляет свойства кислоты, а другая – основания, с последующим образованием катионов и анионов амфолита называется автропротолизом амфипротных растворителей.
В общем виде:
HSolv + HSolv = H2Solv+ + Solv-.
Одна молекула растворителя выступает как кислота, другая как – основание.
Для воды автопротолиз можно представить как:
Н2О + Н2О = Н3О+ + ОН-.
Константа равновесия для воды: 
Т.к. активность растворителя при данной температуре постоянна, то произведение  также остается постоянным и представляет собой ионное произведение воды Кw.
также остается постоянным и представляет собой ионное произведение воды Кw.
Кw = 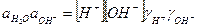
При комнатной температуре
[Н+] = [ОН-] = 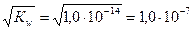 моль/л.
моль/л.
Характеристикой кислотности раствора является водородный показатель рН:
рН = 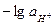
При проведении приближенных расчетов вместо активности ионов водорода используют их концентрацию.
Если имеется раствор сильной кислоты или сильного основания, то протолитическое равновесие полностью смещено вправо, и тогда
[Н+] = сНА и рН = рсНА,
[ОН–] = сВ и рОН = рсВ.
Если имеется раствор слабой кислоты или слабого основания, то при малой степени диссоциации (α < 5%)
[Н+] =  и рН = ½(рКа + рсНА),
и рН = ½(рКа + рсНА),
[ОН–] = 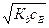
Если имеется раствор амфолита (кислые соли, соли катионокислот – NH4COOH, NH4C6H5COO, аминокислот) то при условии небольших различий между Ка,1 и Ка,2 и пренебрежения автопротолизом:
[Н+] = 
Буферные растворы – это растворы, которые представляют собой смесь кислоты и сопряженного основания.
Например, формиатный буфер НСООН + НСООNa, ацетатный буфер CH3COOH + CH3COONa, фосфатный буфер NaH2PO4 + Na2HPO4, аммонийный буфер NH4OH + NH4Cl.
При введении в такую смесь небольших добавок сильной кислоты или сильного основания изменения рН не происходит вообще или оно не очень велико.
Одним из самых распространенных буферных растворов является ацетатный буферный раствор, состоящий из уксусной кислоты и ацетата натрия. Равновесие в растворе ацетатного буферного раствора можно представить схемой:
СН3СООН = СН3СОО- + Н+
Буферное действие такой системы связано с тем, что в ней имеется противодействие против ионов Н+ и ОН-. При введении в буфер сильной кислоты равновесие несколько сдвинется влево, а при введении сильного основания – вправо. Т.к. в растворе в достаточном количестве имеются и уксусная кислота и ацетат натрия, заметного изменения рН не происходит.
Если [СН3СОО-] = сs, а [СН3СООН] = са, то

[Н+] = К 


Способность буферной системы сохранять постоянство рН определяется его буферной емкостью. Она измеряется количеством молей кислоты или основания, которое требуется ввести в 1 л буферного раствора, чтобы изменить его рН на единицу.
| <== предыдущая страница | | | следующая страница ==> |
| Мембранно-пролиферативный, или мезангиокапиллярный гломерулонефрит | | | Сущность кислотно-основного титрования |
Дата добавления: 2015-07-26; просмотров: 256; Нарушение авторских прав

Мы поможем в написании ваших работ!