
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Окисление жирных кислот
Первым этапом на пути метаболизма длинноцепочечных жирных кислот в клетке является их активация за счет образования ацил-КоА (рис.35). Эту реакцию катализирует фермент - ацил~КоА синтетаза, который локализован на наружной мембране митохондрий. Его регуляторная роль в клеточном обмене жирных кислот ограничена, так как его активность ингибируется нарастающим количеством длинноцепочечных ацил~КоА. Образовавшись, ацил~КоА может депонироваться в виде ТАГ, расходоваться на образование сложных липидов или подвергаться окислению в пероксисомах, митохондриях с энергетической целью. Как уже отмечалось, жирные кислоты играют важнейшую роль в качестве источника энергии в организме.
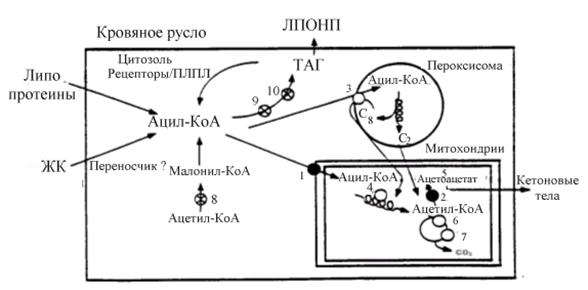
Рис.6.35. Схема окислительных процессов, которым подвергаются жирные кислоты в печени
После образования ацил~КоА жирные кислоты из эндо- и экзогенных источников подвергаются b-окислению при переносе их в митохондриальный матрикс. Пероксисомы могут вносить дополнительный вклад в b-окисление жирных кислот. В митохондриях остатки уксусной кислоты, окисляются в цикле Кребса или используются на синтез кетоновых тел. (·) - основные регуляторные ферменты окисления жирных кислот: 1– КПТм; 2–ОМГ-КоА-синтетаза; (°) - ферменты, которые могут играть дополнительную роль в регуляции окисления жирных кислот: 3 – КПТп; 4–ацил~КоА дегидрогеназа; 5– Д-3-гидроксибутират-дегидрогеназа; 6–изоцитратдегидрогеназа; 7– 2-кетоглютарат дегидрогеназа. (Å) - ферменты, не вовлеченные прямо в окисление жирных кислот, которые косвенно могут играть регуляторную роль в этом процессе: 8– ацетил~КоА карбоксилаза; 9–фосфатидат фосфогидролаза; 9 –диацилглицерол ацилтрансфераза. ПЛПЛ - печеночная липопротеинлипаза
b-окисление. Реакция образования активной жирной кислоты протекает, главным образом, в цитозоле, в то время как процесс b-окисления жирных кислот происходит в митохондриях. Ацил-КоА не может проникнуть в митохондрию без помощи карнитина(рис.6.36), который является широко распространенным соединением, особенно много его в мышцах. Образуется карнитин из аминокислот лизина и метионина в печени и почках. Ацил~SКоА с помощью карнитин-ацилКоА-трансферазы I (карнитин-пальмитоил-трансферазы,КПТн), локализующейся в наружной мембране митохондрий, связывается с карнитином с образованием ацил-карнитина. Транслоказа переносит ацил-карнитин внутрь митохондрий – в митохондриальный матрикс, где карнитин при помощи карнитин-ацилКоА-трансферазы II вновь заменяется на КоА-SH и образующийся ацил~SКоА становится доступным для окисления.
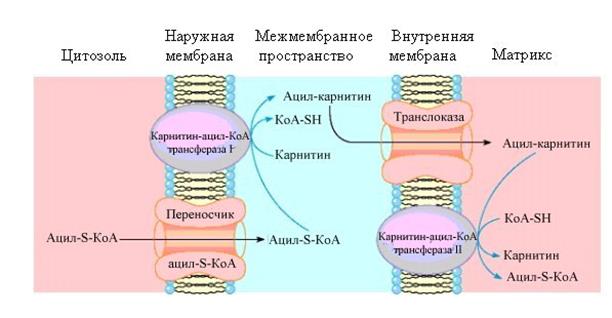
Рис.6.36. Опосредованный карнитином перенос длинноцепочечного ацил-КоА в митохондриальный матрикс
Реакции b–окисления ацил-КоА – это повторяющийся цикл, состоящий из четырех последовательных реакций:
1.Первая реакция дегидрирования катализируется ацил-КоА- дегидрогеназой (реакция 1 на рис.6.37). Существует несколько форм данного фермента, каждый из которых специфичен к ацил-КоА с определенной длиной углеводородной цепи. В ходе реакции отщепляются два атома водорода и образуется еноил-КоА с двойной связью в транс-положении между a и b - углеродными атомами (С-2 и С-3). Водороды передаются на кофермент ФАД, который ковалентно связан с ацил-КоА-дегидрогеназой. Восстановленная форма кофермента служит донором водородов для специфического переносчика электронов,назывемого электронпереносящим флавопротеином, связанным в свою очередь с убихиноном, которому и передает эти водороды. При последующем переносе электронов по дыхательной цепи возможно образование двух молекул АТФ при участии механизмов окислительного фосфорилирования.

Рис.6.37. Последовательность реакций b-окисления жирных кислот: окисление, гидратация, окисление и тиолиз
2.Реакция гидратации (реакция 2, рис.6.37). Еноил-КоА гидратаза катализирует реакцию присоединения воды (гидратация) по месту образовавшейся двойной связи с образованием 3-L-гидроксиацил~КоА. Гидроксильная группа в составе этого соединения находится у b-углеродного атома.
3.Вторая реакция дегидрирования (реакция 3, рис.6.37) катализируется3-гидроксиацил-КоА-дегидрогеназой, которая забирает атомы водорода по месту b-углеродного атома с образованием кетогруппы.Акцептором водородов в ферменте служит НАД+. НАДН+Н+ окисляется НАДН-дегидрогеназой (комплекс I дыхательной цепи)и переносе водородов на кислород позволяет получить до трех молекул АТФ при участии механизмов окислительного фосфорилирования.
4.Заключительная реакция цикла (реакция 4, рис 6.37) катализируется ацетил-КоА-ацетилтрансферазой (тиолазой). Под влиянием фермента и при участии еще одной молекулы КоА-SH от b-кетоацил~КоА отщепляется молекула ацетил~КоА и образуется новый ацил-КоА, укороченный на два углеродных атома. По аналогии с гидролизом эту реакцию назвали тиолизом (распад кетоацил-КоА идет при участии тиогруппы КоА-SH). Образовавшийся ацил-КоА вновь вступает в следующий цикл из четырех реакция.
Большой вклад в изучение данной последовательности реакций внесли Д. Грин, С. Очоа и Ф. Линен. Они и назвали этот процесс b-окислением в соответствии с тем, что окислению подвергается b-углеродный атом остатка жирной кислоты (второй углеродный атом ацила).
b-окисление служит примером особой формы организации метаболических процессов – спиральным процессам. Данный процесс получил название “спирали Линена”. На рис 6.38. представлена последовательность реакций окисления лауриновой кислоты (12 углеродных атомов). Изображены пять витков процесса, позволяющих полностью окислить лауроил-КоА. В результате образуются шесть молекул ацетил-КоА и пять пар восстановленных коферментов (по одной молекуле ФАДН2 и НАДН+Н+ на каждом витке спирали). 
Рис 6.38. Спираль Линена для ЖК с двеннадцатью углеродным атомами
NB! Энергетический выход b-окисления жирных кислот зависит от длины углеводородной цепи.
Суммарная реакция b-окисления лауриновой кислоты:
Ацил-КоА + 5КоА-SH + 5ФАД + 5НАД+ + 5Н2О → 6 ацетил-КоА + 5ФАДН2 + 5НАДН+Н+
При передаче электронов и протонов, полученных при окислении лауриновой килоты по цепи ферментов тканевого дыхания на кислород на внутренней мембране митохондрий создается градиент электрохимического потенциала (гл.4), позволяющий часть энергии трансформировать в энергию АТФ. Приблизительный расчет выхода АТФ в данном примере выглядит следующим образом:
- окисление 5 НАДН+Н+ позволит получить 12,5(15)АТФ (один НАДН+Н – 2,5(3) АТФ);
- окисление 5 ФАДН2 позволит получить 7,5(10)АТФ (один ФАДН2–1,5(2) АТФ);
- окисление до конечных продуктов шести ацетил-КоА -60(72) АТФ(при окислении до конечных продуктов ацетил-КоА в цикле Кребса образуется около 10(12) АТФ). В сумме это составит 80(97) АТФ. Если вычесть из этой суммы две высокоэргические фосфатные связи, использованные на образование ацил-КоА (АТФ расщепляется на АМФ и 2 Фн), то выход АТФ при окислении лауриновой кислоты составит 78(95) АТФ.
Расчет в более общей форме для ЖК с четным числом углеродных атомов выглядит следующим образом:
[(n/2*10(12))+(n/2-1)*4(5)]-2,
где n – число углеродных атомов в ЖК, 4(5)– число АТФ образующихся при окислении водородов, получаемых на каждом витке спирали. Во всех случаях в скобках приводятся значения количества АТФ, наиболее часто используемые в учебных пособиях(см главу 4)
Реакции b-окисления тесно сопряжены друг с другом. Промежуточные продукты неизбежно переходят из одной реакции в другую; кроме наличия субстратов других контролирующих механизмов для этих реакций нет. Уровень b-окисления может возрастать при механической мышечной работе, при уменьшении соотношения ацетил-КоА/ацил-КоА, НАДН/НАД+ и ФАДН2/ФАД.
NB! Жирные кислоты окисляются не только в митохондриях, но и пероксисомах
Интерес к окислению жирных кислот в пероксисомах был вызван тем, что некоторые антигиперлипидемические препараты (производные фибровой кислоты) способствуют пролиферации этих органелл. Впоследствии стало известно, что окисление жирных кислот в пероксисомах составляет около 30% всего их окисления. В пероксисомах содержатся ферменты, которые катализируют b-окисление, имеющее некоторое отличие от процесса в митохондриях (рис.6.39).

Рис.6.39.Окисление ЖК в пероксисомах
Жирные кислоты с очень длинной цепью. Особенностью метаболизма жирных кислот в пероксисомах является расщепление тех из них, которые имеют очень длинную углеводородную цепь или другие необычные радикалы, неспособные подвергаться эффективному окислению в митохондриях. Укорочение алкильной цепи в пероксисомах происходит до тех пор, пока не образуется ацил-КоА со средней длиной цепи. Это обусловлено субстратной специфичностью пероксисомальной ацил-КоА- дегидрогеназы. Образующийся ацил-КоА с восемью углеродными атомами впоследствии подвергается дальнейшему окислению в митохондриях.
Первоначальная стадия дегидрирования в ходе пероксисомального окисления жирных кислот протекает с участием ФАД-зависимой дегидрогеназы, которая в отличие от митохондриальной передает водороды на кислород с образованием Н2О2,которая разрушается каталазой. Все последующие реакции аналогичны происходящим в митохондриях.
Окисление дикарбоновых кислот.В пероксисомах происходит также окисление дикарбоновых кислот, образующихся в ходе w-окисления. Само w-окисление протекает в эндоплазматическом ретикулуме и занимает малую долю в окислительных процессах, которым подвергаются жирные кислоты. При w-окислении гидроксилирование происходит на метильном конце жирнокислотной цепи; в результате образуется дикарбоновая кислота.
Окисление жирных кислот с разветвленной цепью. Растения и молочные продукты содержат фитановую кислоту. Это жирная кислота, имеющая в своем составе 20 атомов углерода и 4 метильные группы. Окисление таких жирных кислот становится возможным в организме благодаря пероксисомальному ферменту - a-гидроксилазе. Недостаток этого фермента сопровождается развитием болезни Рефзума.
Болезнь Рефзума. При болезни Рефзума в тканях и жидкостях организма накапливается фитановая кислота– необычная жирная кислота

|

|
Рис.40.Окисление фитановой кислоты
с разветвленной цепью (рис.6.40). Она образуется из фитола, который поступает в организм с растительной пищей, богатой хлорофиллом. В норме фитановая кислота в пероксисомах подвергается a-окислению. В ходе этого процесса она укорачивается на один углеродный атом с образованием пристановой кислоты и СО2. Пристановая кислота, подвергаясь b-окислению, расщепляется на 3 молекулы ацетил-КоА, 3 молекулы пропионил-КоА и 1 молекулу изобутирил-КоА. У людей с болезнью Рефзума имеется генетический дефект образования рецептора, обусловливающего пероксисомальную локализацию фермента – фитанат гидроксилазы. Интересно, что последующая стадия превращения пристановой кислоты при этом не нарушена. Клиническая симптоматика у таких больных связана с развитием пигментной дегенерации сетчатки, хронической полинейропатии и мозжечковой атаксии, повышением концентрации белка в цереброспинальной жидкости.
| <== предыдущая страница | | | следующая страница ==> |
| Расходование жирных кислот | | | B-Окисление ненасыщенных жирных кислот и жирных кислот с нечетным числом углеродных атомов |
Дата добавления: 2015-07-26; просмотров: 791; Нарушение авторских прав

Мы поможем в написании ваших работ!