
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Образование и утилизация кетоновых тел
Ацетоновые тела являются водорастворимыми формами липидных энергетических источников.
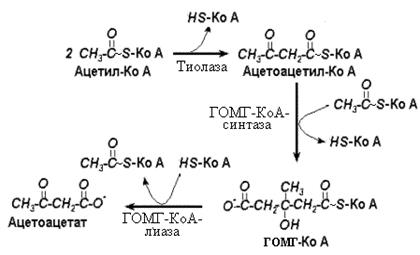
Двумя основными видами ацетоновых тел являются ацетоацетат и b-гидроксибутират - восстановленная форма ацетоацетата. Последний образуется в клетках печени из ацетил~КоА. Образование происходит в митохондриальном матриксе.
Первоначальная стадия этого процесса катализируется ферментом - b-кетотиолазой. Затем ацетоацетил-КоА конденсируется со следующей молекулой ацетил-КоА под влиянием фермента ГОМГ-КоА-синтетазы. В результате образуется b-гидрокси-b-метилглютарил-КоА. Затем фермент ГОМГ-КоА-лиаза катализирует расщепление ГОМГ-КоА на ацетоацетат и ацетил-КоА. В дальнейшем ацетоуксусная кислота восстанавливается под влиянием фермента b-гидроксибутиратдегидрогеназы и в результате образуется b-оксимасляная кислота. Количество ацетоацетата, которое восстанавливается в b-гидроксибутират, зависит от соотношения НАДН/НАД+. Восстановление это происходит под влиянием фермента b-гидроксибутиратдегидрогеназы (рис.6. ). Печень служит главным местом образования кетоновых тел благодаря высокому содержанию ГОМГ-КоА-синтетазы в митохондриях гепатоцитов.
Ацетон образуется из ацетоуксусной кислоты при декарбоксилировании. Из печени поток кетоновых тел попадает во внепеченочные ткани.
Эти реакции происходят в митохондриях. В цитозоле имеются изоферменты - b-кетотиолазы и ГОМГ~КоА-интетазы, которые также катализируют образование ГОМГ~КоА, но в качестве промежуточного продукта в синтезе холестерола. Цитозольный и митохондриальный фонды ГОМГ~КоА не смешиваются.
Образование кетоновых тел в печени контролируется состоянием питания. Такое контрольное действие усиливается инсулином и глюкагоном. Принятие пищи и инсулин снижают образование кетоновых тел, в то время как при голодании стимулируется кетогенез вследствие увеличения количества жирных кислот в клетках. При голодании усиливается липолиз, растет уровень глюкагона и концентрация цАМФ в печени. Происходит фосфорилирование, тем самым активация ГОМГ-КоА- синтетазы. Аллостерическим ингибитором ГОМГ-КоА-синтетазы выступает сукцинил-КоА.
В норме кетоновые тела являются источником энергии для мышц; при продолжительном голодании они могут использоваться центральной нервной системой. Следует иметь ввиду, что окисление кетоновых тел не может проходить в печени. В клетках других органов и тканей оно протекает в митохондриях. Такая избирательность обусловлена локализацией ферментов, катализирующих этот процесс.
Сначала b-гидроксибутират дегидрогеназа катализирует окисление b-гидроксибутирата до ацетоацетата в НАД+-зависимой реакции. Затем с помощью фермента, сукцинил~КоА:Ацетоацетил~КоА трансферазы, кофермент А перемещается с сукцинил~КоА на ацетоацетат. Образуется ацетоацетил~КоА, который является промежуточным продуктом последнего витка b-окисления жирных кислот. Этот фермент в печени не образуется. Именно поэтому там не может происходить окисление кетоновых тел. Зато спустя несколько суток после начала голодания в клетках мозга начинается экспрессия гена, кодирующего этот фермент. Тем самым мозг адаптируется к использованию кетоновых тел в качестве альтернативного источника энергии, снижая свою потребность в глюкозе и белке.
Тиолаза довершает расщепление ацетоацетил-КоА, встраивая КоА по месту разрыва связи между a- и b- углеродными атомами. В результате образуется две молекулы ацетил-КоА.

Интенсивность окисления кетоновых тел во внепеченочных тканях пропорциональна их концентрации в крови. Общая концентрация кетоновых тел в крови обычно ниже 3 мг/100 мл, а средняя ежесуточная экскреция с мочой составляет приблизительно от 1 до 20 мг. В определенных метаболических условиях, когда происходит интенсивное окисление жирных кислот, в печени образуются значительные количества так называемых кетоновых тел.
Состояние организма, при котором концентрация кетоновых тел в крови выше нормальной, называется кетонемией. Повышенное содержание кетоновых тел в моче называется кетонурией. В тех случаях, когда имеет место выраженная кетонемия и кетонурия, в выдыхаемом воздухе ощущается запах ацетона. Он обусловлен спонтанным декарбоксилированием ацетоацетата в ацетон. Эти три симптома - кетонемия, кетонурия и запах ацетона при дыхании объединяются общим названием - кетоз.
Кетоз возникает в результате недостатка доступных углеводов. Например, при голодании их мало поступает (или не поступает) с пищей, а при сахарном диабете, вследствие недостатка гормона - инсулина, глюкоза не может эффективно окисляться в клетках органов и тканей. Это приводит к дисбалансу между этерификацией и липолизом в жировой ткани в сторону интенсификации последнего. В результате большое количество жирных кислот поступает в кровоток, а затем - в клетки. Эти кислоты являются главным субстратом для образования кетоновых тел в печени. Поскольку в результате их b-окисления образуется ацетил-КоА, естественно, что при увеличении количества окисляемых жирных кислот возрастает доля синтезируемых кетоновых тел.
[1] Углеродные атомы в составе жирной кислоты могут нумероваться цифрами или буквами греческого алфавита начиная с первого углеродного атома после карбоксильной группы. Тогда последний углеродный атом независимо от длины углеводородной цепи обозначается буквой ω.
[2] В клетках имеется три различных фермента под названием ацил-КоА- лигаза, с субстратной специфичностью к длинно-, средне- и короткоцепочечным жирным кислотам. Ацил-КоА- лигаза с субстратной специфичностью к длинноцепочечным жирным кислотам (С10-С20) обнаружена в эндоплазматическом ретикулуме и на наружной митохондриальной мембране. Ферменты с субстратной специфичностью к коротко- и среднецепочечным жирным кислотам обнаружены преимущественно в митохондриальном матриксе.
[3] АпоВ-48 получил такое название потому, что в его молекуле содержится 48 % аминокислотного состава апо В-100.
[4] Фермент секретируется в плазму крови из печени. иРНК ЛХАТ обнаружена также в мозге. Однако белок, который там синтезируется, не имеет отношения к фонду ЛХАТ в плазме крови. ЛХАТ плазмы крови - это гликопротеин с молекулярной массой 60 кДа. В результате действия этого фермента образуются два продукта - эфиры холестерола и лизофосфатидилхолин (ЛФХ). ЛФХ является водорастворимым соединением, которое быстро удаляется из ЛПВП через водную фазу. В плазме он связывается с альбумином. В таком виде он легко может захватываться тканями и реэстерифицироваться в лецитин с помощью локализованных в клетках ферментов - ацил КоА-лизолецитин трансфераз. Образовавшиеся ЭХ остаются в плазме крови в составе ЛП.
[5] ЛПБ был открыт в 1976г. Это гликопротеин с молекулярной массой около 70 кДа. Белок может переносить также фосфолипиды. Однако эта способность у него выражена в гораздо меньшей степени, чем по отношению к ЭХ. ЛПБ не может транспортировать свободный холестерол. Предполагается два механизма действия этого белка. Согласно первой гипотезе ЛПБ выступает в качестве растворимого переносчика ЭХ, усиливая степень диффузии этих липидов между различными ЛП. Тем самым комплекс ЛПБ с липидами выступает в качестве стабильного промежуточного продукта транспортной реакции. В соответствии с другим механизмом ЛПБ выступает в качестве своеобразного молекулярного мостика между донором (ЛПВП) и акцептором (ЛПОНП, ЛПНП). За счет этого ускоряется молекулярный транспорт липидов между соединенными поверхностями ЛП. Активность ЛПБ ингибирует специальный белок плазмы крови. Действие ингибитора заключается в отщеплении ЛПБ от связывающих центров на липопротеиновых частицах.
[6] Фермент синтезируется в гепатоцитах, но активным становится на поверхности эндотелиальных клеток печеночных капилляров. Секреция гепатоцитами ПЛ возможна только тогда, когда от углеводной части у N-конца ее полипептидной цепи отщепится остаток глюкозы. Этот фермент обнаружен также в половых железах и других органах, в которых образуются стероидные гормоны. Туда он поступает из плазмы для последующего своего катаболизма. Как и ЛПЛ, печеночная липаза относится к сериновым гидролазам и способна связывать гепарин. Фермент катализирует гидролиз ТГ, с отщеплением радикалов жирных кислот в a и g - положениях, ди- и моноацилглицеролов, фосфолипидов. В отличие от ЛПЛ печеночная липаза не активируется апоС-2 и катализирует реакции трансацилирования. Например:
МАГ + фосфолипид ® ДАГ + лизофосфолипид.
Действие ПЛ на ЛПВП заключается в том, что фермент катализирует расщепление ФЛ на поверхности этих частиц. В результате там увеличивается относительное количество ХС, которое становится большим, чем в клеточных мембранах. Тем самым создаются условия для более активного перехода ХС с ЛПВП на мембраны клеток.
[7] Важность рецепторов в поглощении клетками ЛПНП демонстрируют результаты исследования наследственного заболевания, вызванного дисфункцией рецепторов к ЛПНП. В основе его лежит мутация гена, кодирующего информацию о структуре рецептора. Вследствие дефекта в структуре рецепторы теряют способность эффективно связывать ЛПНП. Заболеванию свойственны три основных признака: избирательное увеличение уровня ЛПНП в плазме крови; образование депо ХС в несвойственных этому местах, в особенности, в сухожилиях (ксантомы) и в артериальной стенке (атероматоз); наследственная передача по аутосомальнодоминантному принципу. Люди, которые унаследовали два мутантных аллеля, имеют более тяжелые проявления заболевания, чем те, у которых имеется один мутантный аллель. Частота встречаемости первого случая составляет 1 на 1 млн населения, а второго - 1 на 500. У гомозигот (две мутантных аллеля) в возрасте до 15 лет развивается общий атеросклероз, который проявляется инфарктом миокарда, стенокардией или внезапной смертью. У гетерозигот (1 мутантный аллель) клинические проявления менее тяжелы. У мужчин в 75 % случаев инфаркт миокарда развивается в возрасте до 60 лет. У женщин ишемическая болезнь сердца встречается реже и в более позднем возрасте.
[8] Значение ЛХАТ для обмена ЛП хорошо прослеживается при заболевании, связанном с врожденной недостаточностью этого фермента у человека. При нем активность ЛХАТ в плазме полностью отсутствует в результате чего в плазме появляются необычные ЛП, обогащенные СХ. ЛПВП лишены ЭХ и имеют дискообразную форму. СХ накапливается в плазматических мембранах клеток: эритроцитов, клеток почек, селезенки, роговицы глаза. Поэтому у таких больных часто наблюдается почечная недостаточность с вторичной гипертриацилглицеролемией, гипохромная анемия, спленомегалия, помутнение роговицы.
[9] Антиатерогенные свойства ЛПВП не ограничиваются участием этих частиц в обратном транспорте ХС. Они также участвуют в утилизации липидов, находящихся в составе липопротеинов, богатых ТАГ. Кроме того, ЛПВП стимулируют образование простациклина и задерживают, следовательно, агрегацию тромбоцитов; они задерживают проникновение ЛПНП в интиму артерий; тормозят пролиферацию гладкомышечных клеток артериальной стенки; способствуют солюбилизации комплексов ЛПНП – гликозаминогликан.
[10] Индекс массы тела (ИМТ) – масса (кг)/рост (м2). ИМТ 25 – 30 кг/м2 расценивается как избыточный вес. ИМТ>30 кг/м2 расценивается как ожирение.
| <== предыдущая страница | | | следующая страница ==> |
| Общие аспекты обмена холестерола в организме, биосинтез холестерола | | | Липидтранспортная система плазмы крови |
Дата добавления: 2015-07-26; просмотров: 374; Нарушение авторских прав

Мы поможем в написании ваших работ!